EMA
」 歐盟 AZ疫苗 疫苗 接種 EMA
「臥底」東京小學150天 英日混血導演揭日本社會秘密
紀錄電影《日本人的養成》是日本女導演山崎艾瑪(Ema Ryan Yamazaki)的最新作品,導演鎖定了日本最大公立小學、擁有上千名學生的東京塚戶小學拍攝,並以一整個學年捕捉該校一年級和六年級學生的童年魔力,觀察他們是如何學習、並開始具備成為日本社會一份子應有的特質。該片獲美媒讚賞「令人大開眼界」,就連以教育聞名的芬蘭媒體,都給予「溫暖無比」的全面好評。紀錄片《日本人的養成》拍攝期間歷經疫情,導演山崎艾瑪還是堅持拍攝。(圖/海鵬提供)從小在大阪長大的導演山崎艾瑪,本身是英日混血,她對日本社會的獨特性十分感興趣,認為日本之所以能成為現在讓全世界稱羨的社會,最關鍵的答案就是因為日本的小學制度。為拍攝《日本人的養成》,山崎艾瑪在學校「臥底」150天,隨時掌握可能發生的事件,總計拍攝了700個小時。期間即使遭逢新冠疫情,她依然不願放棄,認為那是捕捉日本文化特質與教育真實面的絕佳機會,甘冒風險繼續拍攝,果然順利成功,獲美國日本當代電影節(Japan Cuts)盛讚「耳目一新!令人大開眼界」。英日混血導演山崎艾瑪對日本社會的獨特性十分感興趣,進而拍攝《日本人的養成》,貼身記錄小學生的生活及性格養成。(圖/海鵬提供)「日本人總是準時」、「日本人很有禮貌」、「日本人工作努力」,當電影《日本人的養成》在世界各國放映,果然引發驚嘆連連。日本要求學生自己打掃教室的學校體系,每個學生從小都被賦予責任和角色,「群體意識」成為日本獨有的特質。電影《日本人的養成》讓人們重新思考教育的功能並激發對話,更成為任何城市或國家當前教育體系的一面鏡子,連韓國媒體都誇讚該片「充滿樂觀希望」。電影將於10月25日在台上映。

瘦瘦針增自殺傾向?歐盟本周審查 美國FDA初步認定無關連
在特斯拉執行長馬斯克等名人的帶動下,俗稱「瘦瘦針」、「減肥針」的GLP-1藥物(Glucagon-likepeptide-1 agonists類升糖素胜肽-1受體促效劑)成為炙手可熱的減肥聖物,但從去年起便傳出可能會增加輕生傾向,歐洲藥品管理局 (EMA) 將於本週召開一次會議,審查有關 GLP-1 類減肥藥物與自殺傾向是否有關聯的報告。中國附醫健康醫學中心副院長、台灣肥胖醫學會理事長林文元表示,GLP-1藥物本來是一種降血糖藥,在研發過程中,發現血糖下降的同時,體重也在下降,所以在國外很早就用於減重。瘦瘦針藥物種類相當多,目前台灣大致有Liraglutide、Dulaglutide、Semaglutide等3大類,隨著民眾搶買減肥針,全球都出現短缺狀況。歐洲藥品管理局去年接獲冰島通報,1例使用抑制食慾的胰妥讚(Semaglutide類藥物)後導致出現自殺念頭、1例使用善纖達(Liraglutide類藥物)想自殺、另1例使用善纖達出現自殘想法。Liraglutide、Semaglutide類藥物均由諾和諾德(Novo Nordisk)製造。目前歐盟藥物產品訊息中並未將自殺行為列為副作用,相關產品的安全性將由「藥品監測暨風險評估委員會」(Pharmacovigilance Risk Assessment Committee, PRAC)進行評估,日後將考慮是否將審查範圍擴大到「類升糖素胜肽-1受體促效劑」(GLP-1 receptor agonists)的其他藥物。諾和諾德對此回應,GLP-1受體促效劑應用於治療第2型糖尿病已有超過15年的歷史,用於治療肥胖症也有8年的歷史。從大型臨床試驗項目和上市後監測收集的數據中,並無證據顯示其藥物與自殺自殘傾向存有關聯。諾和諾德強調會持續監測正在進行的臨床試驗和實際使用其產品的數據,並與當局密切合作,以確保患者安全和向醫療保健專業人員提供足夠的信息。美國食品藥物管理局 (FDA) 今年1月的初步審查發現不存在自殺關聯,不過,FDA同時警告,鑑於數據有限,不能完全排除有這種風險的可能性,之後將繼續關注這一問題。

深挖減肥神藥潛力? 彭博:藥商正佈局6歲以上兒童肥胖領域
據彭博報導,有知情人士透露,禮來公司(Eli Lilly)正在計劃在6歲以上年齡段的肥胖症患者中測試其糖尿病藥物Mounjaro;諾和諾德(Novo Nordisk)也正在測試其減肥針Saxenda。美國食品藥物管理局(FDA)和歐洲藥品局(EMA)目前都只批准了12歲以上的青少年使用此類療法。據報導引用美國臨床試驗網站ClinicalTrials登記資料顯示,禮來已開始招募10歲的二型糖尿病兒童進行試驗。公司高管也證實確實在向這個領域投入進行創新,以解決所有受影響人群的問題。與此同時,諾和諾德也正在6歲兒童的身上測試其減肥針Saxenda。據了解,Saxenda的主要成分為利拉魯肽(Liraglutide),與減肥神藥中的司美格魯肽(semaglutide)同是GLP-1受體激動劑。諾和諾德的發言人表示,由於定於11月2日公佈第三季業績,公司正處於靜默期,暫無法就試驗細節置評。但無論哪種藥物最終獲得批准,都將成為全球供低齡患者使用的首個GLP-1減肥藥物。到目前為止,美國FDA和歐洲EMA都只批准了12歲以上的青少年使用此類療法。對於製藥商來說,向兒童供應肥胖症藥物有望進一步增強他們的營利能力。本周稍早,高盛集團預測稱,到2030年GLP-1藥物的市場將達到1000億美元。如果這一數字計入對兒童的銷售額,將獲得進一步的提升。

夏日減重好時機 選擇合法減肥藥迎接蜜曲線
炎夏來臨,想到海邊或泳池消暑一下,低頭看看自己身材卻上不了檯面,不禁懊惱,每天都努力地克制食慾、少吃多動,怎麼瘦就是瘦不下來?難道減重也有撞牆期?知名整形醫美集團鄒政家醫師指出,吃太少達不到基礎代謝率,長期下來容易造成生理機能出狀況,影響身體健康,日後一旦回復正常飲食,更會發生體重反彈之溜溜球效應,體重與脂肪便開始不受控制!想要告別脂肪,應了解體重失控成因,並選對享「瘦」方法,就能輕鬆秀出超HOT線條!「腦饞」救星 同步控制飢餓大腦及情緒飢餓加速減重效率鄒政家醫師提到,「飲食行為是體重失控的關鍵原因之一,多數人認為,熱量消耗大於攝取就能減重,卻不一定了解自身進食行為與能量消耗的類型。」而口服減重藥物,特別對情緒進食型和食慾失控型肥胖有不錯的效果,可同時降低飢餓感及食物渴望,進而使體重減輕。根據臨床試驗的結果,有 85% 的受試者在使用後第 56 週內減輕了至少 5% 的體重。同時,已獲得美國 FDA、歐盟 EMA 以及台灣衛福部的核准上市。減重利器 從根本抑制食慾塑造輕纖感鄒政家醫師補充,若肥胖是因食慾過盛導致攝取過多熱量,可選擇減肥筆,其透過抑制食慾的GLP-1類似物,讓人產生飽足感並減緩胃部排空速度,來降低進食量。對於那些不想依靠手術抽脂來減重的人,可以經過專業醫師的全面評估後,使用GLP-1類似物藥物進行夏日減重管理,並結合飲食習慣的調整,可以進一步加速減重效果。「蜜曲線」最後養成,音浪脂雕成就迷人外表、窈窕體態即使透過飲食習慣、輔助藥物配合,順利讓體重及脂肪降低,但對於特定部位的脂肪是無法消除的,例如小腹、上臂的掰掰肉和大腿內外側等。傳統抽脂手術因破壞性大,修復期較長,愛美人士常因出血量多、疼痛度高、術後腫脹及瘀青多日不退等情形,而裹足不前。知名整形醫美集團陳依凡醫師提到,近年來抽脂儀器不斷的更新,與傳統抽脂手法大不相同,新一代音浪脂雕安全性高、恢復期短,特別針對骨架較小的亞洲人改良設計。音浪脂雕利用直徑僅0.9mm的超微細超音波探針溶解脂肪細胞,同時保護周圍組織完整。此外,由於音浪脂雕之超音波探針極小,可選擇性融化脂肪組織,有利於作臉部抽脂手術,連最難減的雙下巴,都能讓皮膚不平整之副作用降到最低,從臉到身體都能進行全方位脂雕,讓您實現窈窕迷人的蜜曲線夢想。▲知名整形醫美集團鄒政家醫師(左)、陳依凡醫師(右)。留意三大原則,慎選衛福部認證診所,安心享「瘦」免煩惱無論用哪種減重方式,需先留意以下原則:吃超過基礎代謝率:每餐熱量不低於基礎代謝率,並搭配健康飲食內容,讓自己瘦得健康也不容易復胖。不要只看體重:減重除了定期觀察體重之外,也要全面了解身形變化及體脂變化。不要快速減重:給自己訂個時間(最好是3-6個月為一循環),避免使用速效及極端的減重方式反而失了健康。陳依凡醫師最後提醒,在接受治療前,慎選衛福部認證診所,並留意診所之療程項目應使用原廠認證正貨,安全更有保障,更重要的是進行前都應先充分諮詢專業的醫師,由醫師來建議專屬的方案,方可使減脂成果更加理想。

「瘦瘦筆」疑似引發輕生念頭! 歐盟宣布展開調查
瘦瘦筆近年在減肥圈爆紅,然而歐洲藥品管理局(The European Medicines Agency ,EMA)近期表示,已接獲冰島通報,1例使用抑制食慾的胰妥讚(Ozempic)後導致出現自殺念頭、1例使用善纖達(Saxenda)想自殺、另1例使用善纖達出現自殘想法,將對此展開調查。名人效應 減肥針全球短缺名人在社交媒體上大量分享減肥貼文,吸引民眾跟風。目前善纖達和Wegovy已獲得減肥核准和許可。Ozempic適用於糖尿病患者,有助於控制血糖和體重。隨著民眾購買填充式減肥針,全球都出現短缺狀況。綜合外媒報導,胰妥讚為GLP-1受體促效劑,主要成分為semaglutide(索馬魯肽),核准用於治療第2型糖尿病;而善纖達含有類似的成分liraglutide(利拉魯肽),核准用於長期體重管理。兩者均由諾和諾德(Novo Nordisk)製造,由於許多非糖尿病患買來用於減重,經常處於全球缺貨狀態。EMA表示將針對善纖達、Wegovy、胰妥讚及其他類似減重藥物進行安全評估。目前歐盟藥物產品訊息中並未將自殺行為列為副作用,相關產品的安全性將由「藥品監測暨風險評估委員會」(Pharmacovigilance Risk Assessment Committee, PRAC)進行評估,日後將考慮是否將審查範圍擴大到「類升糖素胜肽-1受體促效劑」(GLP-1 receptor agonists)的其他藥物。諾和諾德對此回應,患者安全是重中之重,非常重視所有不良事件的報告。GLP-1受體促效劑應用於治療第2型糖尿病已有超過15年的歷史,用於治療肥胖症也有8年的歷史。從大型臨床試驗項目和上市後監測收集的數據中,並無證據顯示其藥物與自殺自殘傾向存有關聯。諾和諾德強調會持續監測正在進行的臨床試驗和實際使用其產品的數據,並與當局密切合作,以確保患者安全和向醫療保健專業人員提供足夠的信息。美國的善纖達處方資料包括建議監測患者是否有憂鬱或自殺念頭,若出現症狀時應停止用藥。在成人臨床試驗發現,服用該藥物的在3,300多人中有9人報告有自殺念頭,而服用安慰劑的1,900多人中只有2人有自殺意念;至於兒科臨床試驗中,125名研究對像中有1人因善纖達自殺而死亡。處方資料稱「沒有足夠的信息來確定與善纖達的因果關係。」美國食品和藥物管理局(The Food and Drug Administration ,FDA)2017年核准Ozempic用於治療糖尿病,並於2021年核准Wegovy用於減肥。官方表示,將繼續檢視獲核准藥品後續的安全性,並規劃檢測和風險評估系統,一旦發現新的警訊,將採取相關應對措施。常見減肥藥7大副作用專家提醒,減肥藥應與健康飲食和運動並用,而且所有藥物都有潛在副作用。部分藥品的仿單已將自殺念頭列入可能的副作用,建議使用者注意自己的情緒、行為、想法、感覺是否出現改變,並盡速尋求醫療協助。噁心嘔吐頭痛腹瀉便秘腹痛疲倦 原文出處:Weight-loss jabs investigated for suicide riskEuropean regulators probe risks of suicidal thoughts in users of popular weight-loss medications 健康醫療網提醒您:自殺不能解決問題,你我都是自殺防治守門人。安心專線:0800-788-995(0800-請幫幫-救救我)張老師專線:1980勇敢求救並非弱者,您的痛苦有人願意傾聽,生命線專線:1995

長期使用3C產品 嚴重恐引起偏頭痛
隨著科技的進步,3C用品成為了日常所需,無論是工作、學習、娛樂、交際等都會使用到3C,但你知道嗎?長期使用3C,不僅會用眼過度,還可能因為長時間低頭,使得肩頸肌肉僵硬而壓迫神經,引起慢性發炎,就會導致偏頭痛。偏頭痛的原因?陳信宏醫師說明,偏頭痛的機轉目前還不是很明確,但這幾年發現周邊神經或中樞神經的末端過度敏感,會有較大的機率引發頭痛。偏頭痛的原因有很多,像是飲食、壓力、睡眠、天氣變化、吃到刺激性食物、荷爾蒙改變或肌肉過於緊繃等因素,都有可能會產生偏頭痛。而偏頭痛通常有遺傳性,根據研究顯示,父母一方有偏頭痛,子女遺傳機率約4~5成,若是父母雙方都有偏頭痛,機率則高達2/3。偏頭痛第一次發作的年齡大概落於15~25歲,而好發年齡則是在30~50歲。臨床觀察發現,女性發生偏頭痛的比例是男性的三倍左右,最主要是因為女性賀爾蒙變化(如:青春期、生理期、懷孕或更年期等),有7成的女性偏頭痛的發作時間與經期有相當的關連性。除此之外,過度勞累或是生活作息不定的人,也較容易產生偏頭痛。根據目前新的研究顯示,肥胖的人機率也比較高,可能是因為運動量少,加上肥胖導致體內發炎物質較多有關,才較容易引發篇頭痛。想解決偏頭痛,有哪些治療方式呢?陳信宏醫師表示,目前治療偏頭痛最主流的方式就是藥物,口服藥物以急性止痛藥為主,因為偏頭痛大多都是陣發型,情況不嚴重者(一個月出現1~2次頭痛情形)就可以使用藥物,但若是發生頻率太高,就要搭配使用其他預防性藥物,例如:抗憂鬱劑、乙型阻斷劑、妥泰等。對於口服藥效果不好、嚴重或慢性偏頭痛的人,可以施打神經阻斷針、肉毒桿菌素或CGRP單株抗體注射等方式來改善偏頭痛。若是以上治療效果都不好的人,則是建議可讓專門醫師評估是否適合接受微創手術治療,去除長期刺激壓迫周邊神經的肌肉血管,使神經恢復健康,能有效改善過度敏感、降低或預防偏頭痛的發生。肉毒桿菌素不僅能用於醫美除皺,還能治療偏頭痛!陳信宏醫師指出,因長期姿勢不良而導致偏頭痛的3C族群,幾乎都會有肌肉過於緊繃的問題,所以要放鬆肩頸區域的肌肉(如:斜方肌、胸鎖乳突肌等)才能改善頭痛問題,將肌肉放鬆後較不會壓迫神經導致發炎而引發頭痛,能定期施打肉毒桿菌素來緩解頭痛,同時也會感覺肩頸比較不會那麼僵硬了。此外,使用3C一定要適時休息、做些舒緩活動,對於肌肉緊繃都能有些微的改善效果,還能透過物理治療或是舒緩按摩等方式,來放鬆肌肉、舒緩頭痛。肉毒桿菌素除了運用在醫美上,經多年研究證實,還能用於治療慢性偏頭痛,肉毒桿菌素治療偏頭痛的原理有兩個,一是肉毒桿菌素能抑制神經末梢的傳導物質「乙醯膽鹼」的釋放,進而使緊繃的肌肉放鬆,當肌肉被放鬆後就不會壓迫神經,此外肉毒桿菌素還能抑制發炎傳導物質,而達到緩解疼痛的效果。肉毒桿菌偏頭痛治療時間約10~20分鐘,在術後1~2周就能感受到治療效果,但少數較嚴重的人可能要治療1~2次才會有明顯效果,建議3個月施打一次、連續施打3個周期,標準治療劑量為155單位(實際治療劑量會依個人體質和問題嚴重程度而有所不同),醫師會根據患者疼痛部位、肌肉緊繃處或壓迫的神經點施打肉毒桿菌素,就能有效減少偏頭痛發作的頻率以及疼痛度。在韓國相當受歡迎的新一代「亞洲肉毒」(韓國俗稱:彩虹肉毒),由韓國知名藥廠經過多年研發,透過與西方接軌的先進HIPURE™專利純化技術,再利用SEC粒徑篩析層法進行過濾,只保留高純度>98%的大分子900KDa的肉毒桿菌素,且經過美國FDA、歐洲EMA和台灣TFDA三重認證,也是目前眾多韓國肉毒品牌中率先獲得多個國際第三方的嚴格認證批准,效果媲美老字號經典肉毒品牌,且價格親民,相當適合需要施打大劑量的人,性價比高且兼具效果與安全。醫師小叮嚀慢性偏頭痛患者應保持正常的生活作息,避免熬夜和過度勞累,才能有效預防偏頭痛發生。現代人3C不離手,因此普遍有肩頸痠痛文明病,一定要適當的休息與伸展讓肌肉舒緩,就可以減少偏頭痛發生的機率。陳信宏醫師特別提醒,偏頭痛是一種複雜和反覆發作的一個疾病,建議尋求擅長處理偏頭痛的醫師做診治,才能有效緩解頭痛問題。(文章授權提供/醫美時尚)更多有關《醫美時尚》:www.dr-beauty.net

荷蘭紅燈區改「大樓化經營」遭歐盟藥管局反對 市長反嗆:性工作者永遠不會消失
荷蘭的阿姆斯特丹擁有合法紅燈區世界聞名,吸引不少觀光客到訪一探究竟,但上個月阿姆斯特丹宣布,將計畫性關閉線有紅燈區的酒吧和餐館,並禁止在紅燈區吸食大麻,將這些店家移到新商辦大樓中,成立系統性情色中心,但不只新地點附近居民反對,連歐盟的藥品管理局都站出來說話,讓阿姆斯特丹市長表示,「性工作者屬於阿姆斯特丹,永遠不會消失」。阿姆斯特丹市府公布三個地點做為新紅燈區大樓,但也引發附近居民強烈反對。(示意圖/翻攝自pixabay)據《BBC》、《衛報》報導,荷蘭的阿姆斯特丹上個月宣布,計畫將協助原本紅燈區的酒吧與餐館,移動到新規劃的紅燈區大樓經營,這樣的情色中心計畫可以容納百名性工作者,裡面有酒吧、餐廳、聲色場所等,並公布可能的三個地點。但卻造成三個地點的居民不悅,不想社區附近成為色情集中地,而歐盟的歐洲藥品管理局(European Medicines Agency,EMA)也跳出來反對,認為情色中心設在靠近藥品管理局附近,恐會給附近地區帶來負面影響。但阿姆斯特丹市長表示,哈賽瑪(Femke Halsema)受訪表示,EMA大樓與預計規劃的情色中心至少有一公里,並表示要打造一個「有格調、人人都不會羞於造訪的色情中心」,擺脫紅燈區是罪犯與受害女子聚集地的傳統形象,並表示「性工作者屬於阿姆斯特丹,永遠不會消失」。

康霈局部減脂新藥二期試驗獲美FDA核准 股價聞訊大漲15%
康霈生技(6919)公告旗下新藥用於減少皮下脂肪(非手術局部減脂)CBL-514二期臨床試驗已獲美國FDA核准執行,此臨床試驗預計於美國、加拿大和澳洲共100位中、重度腹部皮下脂肪堆積受試者。2024年第二季取得臨床統計結果,進行中的授權談判已在持續進行中,今日盤中股價一度大漲15%,股價衝上興櫃以來最高價195.5元。康霈表示,美國FDA針對CBL-514減少皮下脂肪的三期臨床試驗主要評估指標是減少腹部皮下脂肪堆積等級(AFRS)之療效,因此該臨床改用核磁共振更精確的評估治療後減少的皮下脂肪量,以便模擬並取得產品未來關鍵三期臨床試驗的試驗設計條件。若本試驗案完成且主要終點達標,CBL-514將於2024年啟動減少皮下脂肪之全球多國多中心三期樞紐臨床試驗申請。此次FDA核准執行的二期雙盲臨床試驗主要目的為評估CBL-514注射劑用於減少皮下脂肪的療效、安全性與耐受度;將招募100位中、重度腹部皮下脂肪堆積的受試者,試驗分為CBL-514組與安慰劑組。此試驗是多國多中心、雙盲、隨機分配、安慰劑組對照的臨床試驗,且為加快收案速度,將於美、加、澳洲3國進行收案,試驗中心包含3國多位全球知名的PI加入,可同步為產品推進三期樞紐試驗與未來上市做準備。預計今年Q2開始收案,並計畫在2024年Q2取得臨床統計結果。此外,康霈進一步表示,CBL-514目前進行中的授權談判仍將持續,不需等到二期臨床試驗結束。康霈執行長凌玉芳表示,CBL-514注射劑是一種505(b)(1)全新小分子新藥,能誘導脂肪細胞凋亡,可經由注射方式精準減少治療部位脂肪,且不會造成其他組織細胞壞死或損傷,也不會對神經系統、心血管或呼吸中樞造成副作用。根據Grand View Research 2021年調查,2030年全球醫美市場預估為3321億美元;Deloitte中國身體塑形市場行業發展白皮書推估,全球局部減脂市場將超過1000億美元,且現有治療方式療效不佳或副作用大。目前局部減脂75~80%採用侵入性的外科手術,包含抽脂手術與腹部整形術,但外科手術具有嚴重副作用與後遺症,以及致死的高風險。而局部減脂產品的主要用途為減少治療部位的皮下脂肪而非減輕體重,目前局部減脂 75-80% 採用侵入性的外科手術,包含抽脂手術與腹部整形術,不過外科手術具有副作用與後遺症等。凌玉芳表示,並非所有三期臨床都可以申請新藥查驗登記(NDA),關鍵三期臨床試驗,才是攸關一個新藥最後能否獲得美國FDA或歐盟EMA批准上市的臨床試驗,為了降低風險,要求至少要有一個雙盲臨床二期試驗在療效指標達到主要終點統計差異,且與試驗設計高度模擬並取得更多樣且充分的療效數據,以大幅提升未來樞紐試驗成功達標的可能性。

國光生加速國際代工腳步 拚年營收破20億
國光生(4142)11日召開董事會通過第3季財報,受惠訂單成長、生產排程優化,Q3營收再創單季歷史新高,且Q1至Q3累計營收達16.6億元,淨利2.3億元,EPS 0.54元,超越2021全年營收數字。國光生表示,因應下半年出貨的傳統旺季,提前生產、提早出貨,得以提前到Q2開始,隨著製程優化及加速國際代工腳步,將逐步實現季季出貨,年頭旺到年尾的目標。展望明年,除了積極開拓流感疫苗成品及原液外銷的國際市場外,在CDMO部分,天道委託代工產品在第二條自動化產線生產,近日通過歐盟EMA針對新產線的查廠認證,明年委託代工產量可望大幅成長。國光生指出,今年流感疫苗成品和原液外銷生產、出貨時間都提早第二季開始大量出貨。第四季仍有大陸流感疫苗交貨、台灣公費流感疫苗追加訂單,及新增CDMO製程開發業務等,全年營收突破20億元可望達標。國光是台灣唯一加入WHO所屬國際製藥生產聯盟IFPMA的流感疫苗廠,可同步取得WHO的全球流感病毒監測資訊,再加上自主成立流感病毒選株小組,累積多年經驗,對流感病毒株預測日益精準,生產排程得以提早。 今年在流感疫苗成品和原液外銷生產、出貨時間,都較去年早,Q2即開始大量出貨,提前生產加上出貨順利,都具體顯現在營收數字上。未來也將透過提早生產、持續優化製程,讓出貨旺季提前成為常態。展望明年,國光生除天道委託代工產品通過歐盟EMA查廠認證,出貨大幅成長,還有多個CDMO製程合作開發案洽談中,明年可望承接小量、多樣化的代工業務。
男子接種AZ發生「毛細血管滲漏症候群」 核予救濟金40萬元
衛福部疾病管制署公布最新疫苗受害救濟審議結果,共有5案獲得救濟,其中一名台中市60多歲張姓男子,接種AZ疫苗後發生「毛細血管滲漏症候群」,經專家審議,無法確定與疫苗之關聯性,核予救濟金40萬元。疾管署發言人莊人祥說明,此為目前已審議新冠疫苗相關案件中,首例毛細血管滲漏症候群個案。根據疾管署最新公布衛福部預防接種受害救濟審議小組(VICP)第188次會議紀錄,共討論70名個案,其中6案獲救濟金,分別為5案接種新冠疫苗、1案接種卡介苗,依據「預防接種受害救濟基金徵收及審議辦法」,分別核予救濟金1萬至40萬元。本次審議結果中,一名台中市60多歲張姓男子,接種AZ疫苗後出現不良反應,經醫師診斷為毛細血管滲漏症候群,VICP審議結果為「無法確定與接種疫苗關聯性」,依規定核予救濟金新臺幣40萬元。莊人祥指出,目前已審議的新冠疫苗相關案件中,此為首例接種後出現毛細血管滲漏症候群的個案。毛細血管滲漏症候群(capillary leakage syndrome,簡稱CLS)是一種罕見的血液疾病,恐引發多重器官衰竭。台北榮總血液科醫師柯博伸說明,身體遭受外在刺激時引起的免疫反應,不正常的細胞激素分泌,微血管通透性上升,導致液體滲出,在各組織之間流動,可能引發下肢水腫、呼吸喘或呼吸困難、體重增加、腹水等症狀。歐盟藥品管理局(EMA)去年6月宣布,將毛細血管滲漏症候群增列為AZ疫苗的副作用。柯博伸指出,施打疫苗、癌症腫瘤或其他感染因素,都可能引發毛細血管滲漏症候群;屬於疫苗接種的罕見副作用,臨床上極少遇到。
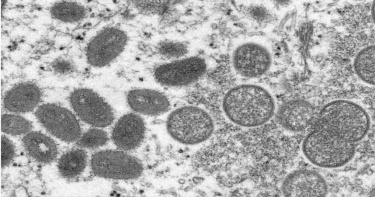
猴痘口服抗病毒藥來了!供重症及免疫低下確診個案使用
疾病管制署(以下稱疾管署)今(28)日表示,我國向國外採購之猴痘口服抗病毒藥物tecovirimat,已於昨(27)日晚間運抵臺灣,將於完成通關及驗收程序後配撥該署各區管制中心。該藥物將由醫師評估治療效益與風險,充分告知病患並獲得同意後提出申請,經審核通過後提供重症及免疫低下確診個案使用。(圖/指揮中心提供)疾管署指出,依據世界衛生組織(WHO)及歐洲疾病管制中心(ECDC)等單位之建議,大多數猴痘患者不需要特殊治療,以輸液治療與維持營養等支持性療法為主,以減輕症狀和併發症。口服抗病毒藥物tecovirimat建議使用於猴痘確診且病情嚴重之病患或免疫低下者。疾管署說明,tecovirimat經歐洲藥品管理局(EMA)核准使用於治療正痘病毒屬之天花、猴痘及牛痘;美國食品藥物管理局(FDA)核准使用於治療天花,美國疾病管制與預防中心(CDC)專案核可使用於治療因猴痘病毒感染惡化為重症或有重症危險因子之高風險患者,以降低死亡機率。我國衛生福利部食品藥物管理署已於今年7月13日同意依據藥事法第48條之2規定,核准其專案輸入。疾管署強調,猴痘已於今年6月23日公告為第二類法定傳染病,目前累計通報13例疑似病例,其中2例境外移入確診病例,感染國家為德國及美國,餘11例已排除;另自 6月30日起,將具有本土或不明感染源猴痘個案之49個國家旅遊疫情提升至「第二級:警示(Alert)」。該署提醒,國人若前往該些國家,應避免可能與不特定人士密切接觸之社交活動等高風險場域,返國入境時如出現發燒、皮膚病灶如紅疹、丘疹、水泡或膿疱等疑似症狀,應主動告知航空公司人員及機場港口檢疫人員,並儘速就醫,告知醫師旅遊史及接觸史。相關資訊可至疾管署全球資訊網( https://www.cdc.gov.tw )或撥打國內免付費防疫專線1922(或0800-001922)洽詢。
接種Novavax恐出現嚴重過敏 美警告過敏者切勿施打
歐盟藥品審查機構「歐洲藥品管理局(European Medicines Agency,簡稱EMA)」14日證實,施打Novavax疫苗可能出現「嚴重過敏」副作用,該疫苗於13日獲得美國監管機構的授權,其在美國的產品標籤警告,對疫苗成分過敏者,不要施打此疫苗。美國監管機構警告,對疫苗成分過敏者,不要施打Novavax疫苗。(示意圖/unsplash)路透社報導,歐洲藥品管理局(EMA)將更新疫苗的產品訊息,增加皮膚異常及減少知覺的副作用。根據歐洲疾病預防和控制中心(European Centre for Disease Prevention and Control,簡稱ECDC)的數據,自去年12月推出Novavax以來,迄今為止,歐洲僅使用了250,000劑Novavax疫苗(歐洲名為「Nuvaxovid」)。歐盟公布,施打Novavax新冠疫苗有嚴重過敏副作用後,Novavax與其他新冠疫苗製造商的股價,在早盤交易中,下跌20.3%至55.72美元(約新台幣1,668元),其中Novavax的股票波動較大。

新加坡推能源多樣化 將從寮國「進口水力發電」…電網橫跨這東協4國
新加坡政府日前宣布與寮國簽署為期2年的初始購電協議,屆時從寮國產出的最高100百萬瓦(MW)再生能源,將透過現有電網輸送至新加坡,而該計畫也被視為實現「東協電網」(ASEAN Power Grid)的探路工程,以及高達95%能源仰賴進口天然氣的新加坡,跨出能源多樣性的下一步。新加坡20年前推動能源轉型,以及2021年啟動「2030年綠色計畫」後,雖將主要能源的供應類型從石化轉為天然氣和太陽能等再生能源,以滿足轉型需要和完成碳中和目標,並預期2030年底可讓太陽能發電量達到總耗電量的3%,但同時也預期到過於仰賴從印尼、馬來西亞進口的天然氣能源,因此在天然氣和太陽能外,推動「區域電網」和如氫氣的其他「新興低碳替代方案」。而新加坡這次從寮國購買的「水力發電」也是新國首度進口再生能源,也代表「寮國—泰國—馬來西亞—新加坡電力整合計畫」(LTMS-PIP)項目和「東協電網」正式啟動和探路。新加坡能源市場管理局(EMA)表示,本次與寮國達成的購電協議,將能替大約14.4萬個四間房供電1年的時間。依照新加坡政府規劃,該國要在2035年進口4千百萬瓦的低碳電力,並占總能源供應約30%,以實現低碳、再生能源發展目標,更重要的是有助於「強化區域國家的能源合作」,尤其氣候變遷以及俄烏戰爭影響,不只電力、天然氣價格全面上揚,各類能源供應與物價都深受其害,今年5月的核心通膨更飆至3.6%,顯示出能源多樣化的重要性。此外,寮國國內的89座發電廠中,有高達78座為水力發電廠,並出口柬埔寨、泰國、越南與緬甸等國家共6千兆瓦,目前也和新加坡商討2028年將太陽能電力傳輸到新加坡的計畫,如果順利完成將成為目前已知全球規模最大的再生能源輸送項目。

毛孩用藥卡關1/高嘉瑜掀「潘朵拉之盒」後 獸醫:還有八成問題未解
立委高嘉瑜日前質詢一起寵物用藥,質疑獸醫師違法使用標靶藥物,意外掀起寵物用藥的「潘朵拉之盒」,也惹來大批飼主強烈抨擊。事後高嘉瑜為了平息這股「野火」,立刻找來相關單位研商,並獲得農委會同意適度鬆綁無藥證的動物用藥輸入門檻。獸醫師強調,這是寵物用藥的一小步,還有八成的用藥瓶頸需要克服。5月2日,高嘉瑜邀集了獸醫師公會全國聯合會、北高獸醫師公會主要幹部、農委會動植物防疫檢疫局副局長徐榮彬和動保行政監督聯盟何宗勳等人,協調放寬現有動物用藥合法管道,會中達成從寬函釋無許可證(無藥證)動物用藥進口門檻,及加速用藥申請的行政審查時間。消息一出不少飼主不吝給予掌聲與鼓勵,但也有人不買單,因為向來反對釋出「調劑權」的藥師並未與會。雖然目前合法動物用藥逾300種,然而其中只有百餘種符合「寵物」用藥,未來適用於貓狗的藥品還是屈指可數。一名在台北執業的獸醫師透露,獸醫界用藥大致分為有藥證動物藥和人用藥、以及沒有藥證動物藥和人用藥等四大類。他列出目前尚未合法的獸醫常用治療藥物,包括了心臟病、內分泌、腫瘤化療和腎衰竭等至少十多種藥物,其中這次高嘉瑜提到爭議用藥「palladia」就在其中,屬於第三種「沒有藥證的動物用藥」;另一名在場的獸醫無奈說,「當初在學校時用的都是這些,執業後才知道,這麼用藥會被檢舉到死啊!」高雄市獸醫師公會常務理事蕭序諺表示,獸醫並非不想使用合法的動物藥品,但藥證申請上困難重重,光是在防檢局的登記證申請就非常嚴格,時間一拖三至五年,且台灣寵物數量約三百多萬隻,美國寵物市場約八千萬隻,日本約兩千萬隻,台灣市場規模相當小,且申請後也並非適用所有寵物,因此根本沒有藥商想申請藥證。嘉義市動物守護協會理事長吳育才指出,每當發生獸醫或藥商被檢舉使用或販賣人用藥,緊接而來的就是藥品斷貨潮或漲價潮。(圖/嘉義市動物守護協會提供)蕭序諺指出,此次為獸醫開通無藥證動物藥品的窗口,然而人用藥物才是動物用藥的主要來源,在國外獸醫治療寵物的八成以上藥物,皆為人用藥物,其中包括有藥證人用藥與沒有藥證的人用藥;但國內動物禁用人用藥品,而動物藥品又分經濟動物(牛羊雞豬等)與非經濟動物(犬貓兔等寵物),其中純寵物用藥不到100項,像是外用藥、滴劑等,而純動物用抗生素僅三種;而動物用人藥根據現行法規為「正面表列」,僅清單上的514項。因此像是破傷風藥、腫瘤化療藥物、心臟病、內分泌、腫瘤化療、腎衰竭、腎上腺皮質素等藥品,礙於未列入「獸醫師專案申請人用藥品治療動物之暫行替代品項」(人醫動物用藥)正面表列清單,延誤治療時程的黃金時間屢見不鮮,去年在立委陳亭妃協調之下,農委會防檢局已成立「動物緊急需用人藥治療平台」,讓獸醫師可以透過平台第一時間取得用藥。針對獸醫使用514項正面表列以外的人用藥品,蕭序諺指出,光就生理食鹽水來說,目前合法的動物用生理食鹽水只有500CC一種,但動物用食鹽水和人用成份並沒有不同,在治療動物時多數只要20CC,即使是化療也只要100CC,「500CC根本是逼我們只能選擇一種規格」,且還會有重複使用的污染風險。對此,執業十年的獸醫鍾沂勳建議,簡化藥商的藥證申請流程,增加寵物用藥許可品項,並建議經濟與非經濟用藥分離,避免歸類為非經濟動物的寵物用藥受限;蕭序諺則建議,若某種動物藥上市超過十年,並且取得美國食品藥品監督管理局(FDA)、歐盟藥品管理局(EMA)以及日本農林水產省(MAFF),三者其中兩者的動物藥品登記證,其安全性和普及性都有很高的代表性,農委會應該許可直接發給藥證。獸醫鍾沂勳建議,在無藥證動物用藥方面,可簡化藥商申請藥證的流程,增加進口意願,同時將經濟與非經濟動物用藥分離,增加適合寵物治療的藥品。(圖/吳婉瑜攝)

我新冠健康證明配合歐盟修正 未滿18歲民眾基礎劑有效期為365日
中央流行疫情指揮中心今(13)日表示,歐盟執委會指出,歐盟數位新冠證明(EU-DCC)中之疫苗證明,鑑於12歲以上民眾之追加劑雖已獲歐洲藥品局(EMA)核准,惟並非各國均已實施,因此修正基礎劑僅限於18歲(含)以上有效期限為270日,未滿18歲之民眾所持證明基礎劑有效期限仍為365日,並希望各EU-DCC成員國配合修改各國查驗程式。指揮中心指出,我國「數位新冠病毒健康證明查驗程式」( https://dvc.mohw.gov.tw/verifier-web )將配合於今日改版,此項修正不影響申辦平臺及已核發之數位證明,系統將自動判斷未滿18歲之民眾所持證明基礎劑有效期限仍為365日。指揮中心提醒,由於必須配合歐盟資料更正,各場所使用查驗程式,可透過重新連線至查驗程式網站,並清除使用者端的快取記憶,以利保持最新驗證邏輯。詳細數位證明申辦及驗證系統操作方式可以參考衛生福利部官網數位證明專區( https://covid19.mohw.gov.tw/ch/np-5345-205.html )。(圖/疾管署提供)(圖/疾管署提供)(圖/疾管署提供)

丹麥開歐洲第一槍 宣布開打「第4劑疫苗」連這國都想跟進
新冠肺炎持續在國際延燒,不少國家都出現新一波疫情高峰,由於變種新病毒株Omicron傳播力強又快,也讓不少國家再推完打第三劑疫苗後,決定推打第四劑,丹麥就是歐洲第一個將施打第四劑的國家,另外匈牙利也傳出將跟進。丹麥近日確診數每天都破萬例,且他們接種第2劑疫苗者佔全國五分之四,還有超過半數的人都已施打第3劑疫苗,但確診數依然居高不下,不過他們也發現住院率與死亡數下降與穩定,所以即使在確診數的狀況下,依舊重新開放電影院、劇場、體育館等等設施,丹麥的衛生部長修尼克(Magnus Heunicke)則指出,由於新冠病毒傳播力變得更廣,因此決定針對施打加強劑的民眾,提供第4劑疫苗,也成為歐洲第一槍,甚至考慮讓高齡族群也優先施打。而在丹麥宣布開打第四劑後,也傳出匈牙利即將跟進的消息。另外以色列、智利已開始接種第4劑疫苗。不過有防疫專家則警告,接種太多疫苗可能會損害身體抵抗病毒的能力,還可能會導致免疫系統疲勞。歐盟藥品監管機構(EMA)也對接種第4劑疫苗的必要性感到質疑,但現階段尚無足夠證據來支持打第4劑的有效性。

因應Omicron變異株疫情 輝瑞口服藥「Paxlovid」獲歐盟緊急授權
為了因應持續升溫的新冠肺炎Omicron變異株疫情,歐盟藥品管理局(EMA)17日宣布緊急授權輝瑞口服藥「Paxlovid」。日後歐盟國家可以在患者確診初期,就投放藥物來進行疫病的治療。根據《路透社》報導指出,一般治療新冠肺炎的藥物必須透過靜脈注射投藥,而輝瑞口服藥「Paxlovid」的最大特色就是「口服」,而且他可以在患者感染新冠肺炎初期近期為期5天的療程,甚至不用住院,居家服藥即可。而輝瑞之前也發表聲明指出,「Paxlovid」可以有效減少90%患者重症率與死亡率。歐盟藥品管理局(EMA)在聲明中指出,雖然這款藥物目前在歐盟尚未獲得正式批准,但現在可以用它來治療那些目前不用輔助供氧、且高機率演變成重障的成年患者。有鑑於近期歐盟各國新冠肺炎疫情確診人數與死亡人數的增加,如果各國政府要提前使用「Paxlovid」,EMA這邊會給予支持。報導中指出,目前新冠肺炎口服藥分別有美國默沙東集團(Merck & Co)抗病毒口服藥莫納皮拉韋(molnupiravir)與輝瑞的「Paxlovid」,歐盟已經與這兩間廠商進行價格與需求的談判會議,但目前尚不清楚何時會啟動藥品的聯合採購,以及有多少國家會透過歐盟採購,或是自己單獨採購。
賽諾菲自主回收3款高血壓藥物 聲明曝光原因
由於驗出疊氮類不純物(AZBT),食藥署今公告回收3款賽諾菲高血壓藥物,賽諾菲稍早發佈聲明回應,強調本次屬於自主性回收,且是針對一月份前的藥品回收,一月份後進口的藥品已改變製程,符合國內的最高標準,用藥安全無虞。賽諾菲聲明內容如下:1.歐洲藥物監管局EMA 於今年一月份通知賽諾菲Irbesartan 原料藥中之疊氮物質超過標準 ,賽諾菲即更改製程並取得監管當局核可。2.台灣食藥署亦於今年下半年抽查國內廠商,針對一月份起該不純物超過標準藥品進行回收,但由於賽諾菲今年一月份進口台灣該藥品皆已符合標準,因此未在此強制回收名單內。雖符合食藥署之要求,賽諾菲以更高標準,率先針對一月份前之批次(2018~2020共九批次)進行自主回溯性回收。3.生產過程中產生的AZBT(疊氮)不純物被認為是一種突變原(mutagenic ),可能引起細胞內脫氧核糖核酸(DNA)的變化 。賽諾菲以相關臨床數據等文獻了解並沒有任何跡象顯示藥品導致相關不良反應。全球藥品監管機構亦未接獲任何相關不良事件並將持續追蹤。

越南疫苗護照暫認9款廠牌 台灣高端疫苗並不在內
新冠肺炎疫情在東南亞仍未降溫,其中,越南共有8萬31643起確診病例,死亡人數達到20337例,在東南亞算是疫情較為嚴重的國家之一,據越南衛生部統計,截至9月底,越南全國共施打近4000萬劑疫苗,其中約3100萬人已接種第一劑,逾800萬人打完兩劑,疫苗接種率並不算高。為了防範疫情,越南暫停國際觀光客入境1年半,官方為了振興觀光和旅遊產業,正在制定疫苗護照方案,據目前擬定的方向,共計採認9種廠牌的疫苗,台灣的高端疫苗並不在內。越南外交部發言人黎氏秋姮。(圖/達志/美聯社)越南外交部7日舉行線上記者會,根據發言人黎氏秋姮(Le Thi Thu Hang)指出,面對疫情,越南會從清零的思維,轉為安全、靈活的有效控制疫情,也就是從原先嚴格防範疫情擴散的方法,轉為同步兼顧社會經濟發展的方向。越南政府同意由外交部提交的疫苗護照實施標準;針對疫苗廠牌,則將認可獲得世界衛生組織(WHO)、美國疾病管制暨預防中心(CDC)、歐盟藥品管理局(EMA)以及越南衛生部核准緊急使用授權的疫苗。根據越南官媒越通社(VNA)指出,這幾款疫苗廠牌包含阿斯特捷利康(AstraZeneca,AZ)、嬌生(Johnson &Johnson)、莫德納(Moderna)、輝瑞/BNT(Pfizer/BioNTech)、俄羅斯衛星-V(Sputnik V)、中國國藥(Sinopharm)、Hayat-Vax(中國國藥集團與阿聯合作生產的疫苗)和阿布達拉(Abdala,古巴國產疫苗);除了上述8款疫苗,也將承認北京科興(Sinovac)疫苗。黎氏秋姮同時表示,越南文化體育旅遊部正在與相關部門討論試點計畫,允許越南富國島(PhuQuoc)在疫苗護照的架構下試點重新迎接國際旅客,這項計畫預計11月上路。
高端執行歐盟EMA疫苗免疫橋接第3期試驗 爭取歐盟認證
美國宣布11月起,外國成年旅客入境須完整接種兩劑疫苗才可入境,據世界衛生組織現階段共核准7種疫苗,除了美國核准的莫德納、BNT及嬌生外,還有AZ、中國國藥、中國科興及Covishield(印度版AZ),至於我國產高端疫苗是否有機會獲得國際認證?高端疫苗於22日公告,高端新冠肺炎疫苗在歐盟之第3期試驗,將規劃以多國多中心方式,與歐盟已上市之新冠肺炎疫苗進行免疫橋接比對試驗,目標盡快取得歐盟認證。高端表示,今年6月由全球主要國家之法規單位所組成的「ICMRA國際藥物監管機構聯盟」,已於會議中達成以免疫橋接進行臨床試驗設計的目標共識。在ICMRA會議之後,日本藥政法規單位PMDA已核准日本第一三共藥廠,以免疫橋接方式執行3期試驗;韓國藥政法規單位MFDS,也在ICMRA會議後,核准韓國SK藥廠,以3990人規模,與AZ比較進行3期免疫橋接試驗。另外,在日韓核准國內藥廠以免疫橋接執行新冠疫苗3期臨床試驗之前,法國疫苗廠Valneva,今年4月21日於英國取得3期IND許可,並在6月3日完成招募4000名受試者,預期年底將可取得全病毒去活化新冠疫苗VLA2001與AZ疫苗的免疫橋接3期期中分析數據。高端表示,除了日韓以外,由澳洲、加拿大、新加坡、瑞士、英國所組成的「AccessConsortium跨國醫藥聯盟」,也在今年9月16日發表聯合聲明,表態支持ICMRA的會議結論,將以免疫橋接方式授權新的新冠肺炎疫苗。這次取得歐盟EMA正面回應後,高端董事會通過新冠肺炎歐盟3期免疫橋接試驗初步預算,並確認相關試驗設計原則,後續會依歐盟EMA之科學諮詢結論建議,盡快向EMA提出3期臨床試驗申請,包括巴拉圭的臨床試驗也持續進行中,將用於取得當地臨床資料以進入中南美洲市場。