蛋白激酶
」 國衛院
棘手惡性皮膚癌治療露曙光 國衛院「跨國研究」發現致病關鍵
肢端黑色素癌是一種惡性皮膚癌,主要發生在手掌、腳底、手足指甲床等區域,常發生於亞洲人、拉丁美洲人、非洲人等非白人族裔中。陽光中的紫外線造成基因突變是黑色素皮膚癌的成因之一,已知約有將近50%的黑色素皮膚癌帶有BRAF基因突變,可使用BRAF抑制劑進行標靶治療。然而在肢端黑色素癌發現的BRAF基因突變率極低,表示肢端黑色素癌的成因與黑色素皮膚癌不同,但也意味著肢端黑色素癌目前仍缺少有效的治療標靶。國家衛生研究院癌症研究所沈哲宏助研究員領導團隊與高雄醫學大學及日本九州大學合作,進行跨國肢端黑色素癌研究,以組織免疫染色結合臨床特徵分析87名受試者的癌組織檢體,在惡化程度較高及存活時間較短的受試者檢體發現顯著高量的瞬時受體電位褪黑素蛋白TRPM1 (transient receptor potential melastatin 1)表達。研究團隊更進一步解開TRPM1調控癌細胞惡性化的關鍵分子機制,並提出可能的治療策略。本研究已於今(112)年1月發表於知名國際期刊《Journal of Advanced Research》。TRPM1是細胞膜上可控制鈣離子通透細胞的蛋白,正常存在皮膚和眼睛的色素細胞,目前對TRPM1參與調控黑色素皮膚癌的侵襲及轉移能力的分子機轉研究尚不清楚。研究團隊藉由透過監測胞內鈣離子濃度和鈣離子訊號傳遞激酶CaMKII (Ca2+/calmodulin-dependent kinase II)的活性,發現TRPM1的大量表現會增加細胞內鈣離子濃度,提升CaMKII的活性,進而活化下游蛋白激酶B(AKT)的訊息傳導路徑,促進細胞生長、移行、侵犯及肢端黑色素癌惡性化。研究團隊從受試者提供之檢體成功分離並培養了台灣本土TRPM1高表達肢端黑色素癌細胞株CA11,在細胞實驗中證實CaMKII抑制劑KN93能壓制CA11細胞生長、移行和侵犯能力,在動物模型實驗中也觀察到KN93能夠顯著抑制CA11腫瘤生長,顯示抑制CaMKII活化可作為壓制TRPM1促癌能力的潛力治療方向。過去已知黑色素癌常見的基因突變極少發生在肢端黑色素癌,因此肢端黑色素癌缺少有效標靶藥物。此研究找到新穎TRPM1參與肢端黑色素癌惡性化途徑,除了揭示TRPM1可作為肢端黑色素癌惡化的新分子標誌外,也評估抑制其下游CaMKII活性作為肢端黑色素癌的治療策略的潛力。期待研究結果可作為未來肢端黑色素癌治療上的參考,對相關藥物與療法的研發有所助益。
國衛院發現「快速感染新機制」 有助新冠藥物與疫苗研發
新冠肺炎疫情爆發至今已2年有餘,在全球蔓延造成高達5.8億人感染,600多萬人死亡,新冠肺炎病毒在進入人體後主要藉由病毒表面的棘蛋白(spike protein, S蛋白)與人類呼吸系統上皮細胞表面的ACE2受體結合感染細胞,然而正常上皮細胞其實僅表現低量的ACE2蛋白,卻在感染後迅速誘發急性嚴重的呼吸道症狀,若能找出它快速傳播的機制,就有機會找到降低傳染的方法與策略。國衛院免疫醫學中心譚澤華特聘研究員與莊懷佳助研究員團隊研究發現,受新冠病毒感染細胞中的蛋白激酶MAP4K3(又稱GLK)表現量較正常細胞多,且GLK高量表達之上皮細胞比例與疾病嚴重度正相關,並與國衛院感染症與疫苗研究所周彥宏研究員合作,運用活體新冠病毒小鼠實驗證實此感染機制是新冠病毒可大幅感染的關鍵,同時也能解釋新冠疫苗造成副作用的機制。研究成果於今年7月發表於全球知名醫學期刊《EMBO Molecular Medicine》。研究團隊分析COVID-19病患檢體之單細胞RNA定序結果,意外發現新冠病毒進入宿主上皮細胞後,棘蛋白會誘發蛋白激酶GLK高量表現。接續運用蛋白質體學、各種生物化學實驗證實,過量表現的GLK會磷酸化ACE2蛋白,使ACE2躲過泛素酶UBR4的泛素化降解機制,造成細胞表面的ACE2蛋白穩定增加。同時,GLK過量表現誘發裝載著ACE2蛋白之胞外小體釋出,傳遞予其他原本ACE2表現量不高的細胞,這些接收了ACE2蛋白的細胞更容易被新冠病毒所感染。研究人員分析COVID-19病患的血清檢體相較正常人之檢體,也發現GLK磷酸化的ACE2蛋白以及裝載著ACE2蛋白之胞外小體大幅增加。這些研究成果證實蛋白激酶GLK過量表現為COVID-19致病機轉之關鍵因子,同時說明新冠病毒快速引發臨床症狀且容易傳播的原因。研究團隊運用小鼠模式進行動物實驗,當利用GLK之小分子抑制劑(verteporfin)可調降細胞表面ACE2蛋白量,並降低ACE2胞外小體的產生,進而成功抑制小鼠新冠肺炎病毒感染率。而verteporfin與其它可調控GLK及ACE2相關之藥物,皆具潛力成為抑制新冠病毒感染之候選藥物。此外,研究成果可進一步解釋新冠肺炎引發嚴重發炎反應以及新冠肺炎疫苗產生副作用之機制。新冠肺炎疫苗中主要成分為棘蛋白或棘蛋白RNA,棘蛋白也可能會刺激誘發免疫細胞產生過量GLK,而導致強烈的發炎反應,造成疫苗之副作用。期待透過進一步解開疾病致病機制,進而幫助治療藥物與疫苗的研發與篩選,開發緩解疾病症狀之新穎醫療方式,促進全體人民之福祉。
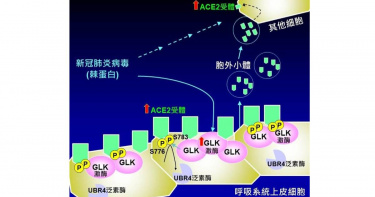
全球5.8億人大規模感染 最新研究曝新冠肺炎染疫關鍵!
新冠肺炎疫情爆發至今逾2年,釀成全球5.8億人感染、600多萬人死亡。國家衛生研究院研究發現,人體細胞中的蛋白激酶MAP4K3(又稱GLK)是造成大規模感染的關鍵,同時也能解釋了新冠疫苗造成副作用的機制;動物實驗發現,透過調控GLK可抑制小鼠感染新冠病毒。該研究可望幫助研發或篩選新冠藥物及疫苗,開發減緩疾病症狀的新穎醫療方式。新冠肺炎病毒(SARS-CoV-2)在進入人體後,主要藉由病毒表面的棘蛋白(spike protein,S蛋白)與人類呼吸系統上皮細胞表面的ACE2受體結合感染細胞。然而,正常上皮細胞只表現低量的ACE2蛋白,卻在感染後迅速誘發急性嚴重的呼吸道症狀,若能找出病毒快速傳播的機制,就有機會找到降低傳染的方法與策略。國衛院免疫醫學中心特聘研究員譚澤華與助研究員莊懷佳團隊研究發現,受新冠病毒感染細胞中的蛋白激酶MAP4K3 (又稱GLK)表現量較正常細胞多,且GLK高量表達的上皮細胞比例,與疾病嚴重度呈現正相關;經小鼠實驗證實,該感染機制正是新冠病毒可大幅感染的關鍵,同時也能解釋新冠疫苗造成副作用的機制。研究團隊分析新冠肺炎病患檢體的單細胞RNA定序結果,意外發現新冠病毒進入宿主上皮細胞後,棘蛋白會誘發蛋白激酶GLK高量表現;接續運用蛋白質體學、各種生物化學實驗證實,過量表現的GLK會磷酸化ACE2蛋白,使ACE2躲過泛素酶UBR4的泛素化降解機制,造成細胞表面的ACE2蛋白穩定增加。同時,GLK過量表現誘發裝載著ACE2蛋白之胞外小體(exosomes)釋出,傳遞予其他原本ACE2表現量不高的細胞,這些接收了ACE2蛋白的細胞更容易被新冠病毒所感染。研究人員分析新冠肺炎病患的血清檢體,也發現GLK磷酸化的ACE2蛋白以及裝載著ACE2蛋白的胞外小體大幅增加。這些研究成果證實,蛋白激酶GLK過量表現是新冠肺炎致病機轉的關鍵因子,同時說明了新冠病毒快速引發臨床症狀且容易傳播的原因。小鼠動物實驗亦發現,當利用GLK小分子抑制劑(verteporfin)可調降細胞表面ACE2蛋白量,並降低ACE2胞外小體的產生,進而成功抑制小鼠新冠肺炎病毒感染率;而verteporfin與其它可調控GLK及ACE2相關之藥物,皆具潛力成為抑制新冠病毒感染之候選藥物。此外,該研究成果可進一步解釋新冠肺炎引發嚴重發炎反應以及新冠肺炎疫苗產生副作用之機制。新冠肺炎疫苗的主要成分棘蛋白也可能會刺激誘發免疫細胞產生過量GLK,而導致強烈的發炎反應,造成疫苗副作用。

紅斑性狼瘡治病關鍵找到了! 國衛院揪出「基因兇手」助及早診斷
自體免疫疾病是我國十大重大傷病第三名,也是門診第三常見疾病。它是一種人體內的免疫系統異常活化而攻擊自己身體正常細胞的疾病,例如全身性紅斑狼瘡、類風濕關節炎、僵直性脊椎炎等。自體免疫疾病往往難以早期診斷出來,因而延遲了治療時機。患者飽受病痛之苦,必須終生治療與用藥,承受藥物引發的副作用,因此自體免疫疾病的早期診斷與治療是醫界長久以來的挑戰。臨床上很難及早診斷症狀輕微的全身性紅斑狼瘡(SLE),並且發現SLE患者多為女性(占9/10),病患家族中也常發現不只一位家人罹患SLE。國衛院免疫醫學中心譚澤華特聘研究員與莊懷佳助研究員團隊,與台中榮總副院長藍忠亮醫師(現中國醫副院長)、高醫大顏正賢前院長組成合作研究團隊,以及台中榮總免疫風濕科洪維廷醫師、陳一銘醫師共同研究,證明MAP4K3 (又名GLK)蛋白激酶基因變異為SLE關鍵致病因子。此項研究已在今(2021)年10月發表於全球知名、風濕病醫學領域研究型第一名期刊《Annals of the Rheumatic Diseases》。國衛院譚澤華特聘研究員率合作團隊,自2009年起研究SLE致病成因與精準之生物診斷標記,分析臨床檢體及基因改造小鼠研究,在2011年首度發現調控發炎反應的酵素蛋白激酶GLK是自體免疫疾病SLE的致病關鍵。再歷經7年研究,證實GLK過量表現在SLE病患之T淋巴細胞中,誘發IL-17A細胞激素大量產生,是造成許多自體免疫疾病的元凶。然而,GLK過量表現於SLE病患中的成因,多年來仍懸而未解。為了增進統計分析之信賴度及研究結果之廣效性,研究團隊結合了中榮及高醫兩端的SLE病患檢體,以深度次世代基因定序(30萬reads/ gene)分析健康者、SLE病患、病患家屬之DNA樣本共431例。研究發現高達四成的SLE病患帶有GLK基因之體細胞性基因變異(somatic variant)或遺傳性基因變異(germline variant),這些基因變異造成GLK之mRNA或是蛋白質過度穩定而增量,因而誘發IL-17A細胞激素產生,導致自體免疫疾病。若能定期追蹤帶有GLK基因變異的女性家族成員,可望藉由基因檢測篩檢,提早在輕症時即診斷出SLE,以利及早治療。除了鑑定出SLE疾病相關之基因變異,國衛院免疫醫學中心團隊乃全球首度為MKRN4基因驗明正身,推翻科學界既往認定MKRN4為「假基因」(pseudogene)的概念。研究證明MKRN4實為帶有重要功能之泛素酶,MKRN4泛素酶負責將過多之GLK泛素化且引發GLK降解而減量。然而帶有特定的GLK基因變異時,則會逃脫MKRN4調控之GLK降解作用,造成GLK在T淋巴球中過量表現,誘發IL-17A導致之自體免疫反應。目前國際上研發的治療自體免疫疾病療法著重於生物製劑,如:抗IL-17A抗體目的在抑制細胞外過量的IL-17A,然而抗體藥發展成本較高。譚澤華特聘研究員研究團隊已開發可精準鎖定GLK之小分子抑制劑,直接從源頭關掉使IL-17A無法產生,具有潛力發展為成本較低的自體免疫疾病小分子標靶藥物,期待進一步推展臨床試驗。此次多機構長年不懈的合作研究,帶來高度臨床應用價值的發現,GLK基因深度定序期待推動成為全身性紅斑狼瘡或是其他自體免疫疾病的精準個人化醫療基因檢測項目,嘉惠自體免疫疾病高風險族群。

【美麗情報】法國麗妒思 給自己巨星般的肌膚呵護
提升顏值,首要是養好肌底,在肌膚保養這件事上,愈來愈多人選擇補充膠原蛋白,然而市面上產品眾多,讓人看了眼花撩亂,很難抉擇哪一款才是真正適合自己的好膠原。近期IG網美、部落客、KOL推薦的頂級膠原蛋白產品,首推法國Ladoux Collagène「麗妒思」膠原蛋白精華飲,商品是由時光安好生物科技(股)公司與法國獨家技術合作,使用世界級大廠Copalis「天后級」膠原蛋白原料,針對亞洲女性肌膚需求所調配之獨家配方,法國原裝進口,並獲得SGS認證、清真認證。想找回肌膚的澎亮潤澤,有感關鍵是補充「優質的小分子魚膠原蛋白」,它是許多女性對抗初老的不二首選。麗妒思膠原蛋白飲的活性膠原蛋白胜肽分子,與脯氨酸、甘胺酸進行協同作用;加上世界級專利大廠原料HAPLEX®PLUS玻尿酸的高效補水力。白藜蘆醇源自天然多酚,化合物結構帶有OH基,藉由活化組蛋白去乙醯基酶SIRT1、腺苷酸活化蛋白激酶,抵抗自由基。乳清蛋白中的半胱胺酸,能維持體內的谷胱甘肽(GSH)水平,發揮抗氧化作用。四大主要成分,如此完美的護膚協同作用,妳還不心動嗎?時光安好官方網站:https://www.timewell.com.tw/SalePage/Index/6737909時光安好FB粉絲專頁:https://www.facebook.com/TimewellBioTech