臨床試驗
」 台股 健保 癌症 新藥 藥華藥
突破舊框架!新一代生物製劑健保給付,嚴重氣喘控制再升級
【健康醫療網/呂佳恆報導】氣喘的臨床表現多樣化,為治療帶來諸多挑戰。然而,隨著醫療科技的進步,現代醫學已成功開發出精準治療的生物製劑。由於不同患者的體質與誘發因子差異顯著,加上環境變遷的影響,氣喘的臨床表現變得愈加複雜。台大醫院雲林分院胸腔內科主治醫師陳彥甫指出,過去的生物製劑治療主要針對第二型發炎(Type 2 inflammation)患者,雖然取得了一定的成效,但對於非第二型氣喘(Non-type 2 inflammation)患者的效果相對有限。隨著新一代生物製劑的問世,不僅能有效控制第二型及非第二型氣喘,甚至對於具有複雜混合型氣喘的患者,也展現出卓越的治療效果,為患者帶來更多希望。治療合併肥胖、鼻瘜肉及混合型複雜的氣喘患者 新一代生物製劑展現療效目前臨床上,透過生物標記已能為嚴重氣喘(Severe asthma)患者選擇合適的生物製劑治療方案。然而,由於氣喘的複雜性,例如患者抽菸、合併肥胖、鼻瘜肉、皮膚過敏或黏液栓塞(mucus plugging)等因素,生物製劑的治療效果在某些情況下仍然面臨挑戰。陳彥甫醫師指出,有些嚴重氣喘患者的生物標記指數並非每項都特別高,甚至可能所有指數都不顯著升高。然而,新一代生物製劑的問世,為非第二型氣喘及混合型氣喘患者提供了全新的治療選擇。陳醫師進一步說明,特別是合併肥胖的嚴重型氣喘患者,其病情難以控制通常與嗜中性球發炎密切相關。新一代生物製劑能有效控制非第二型氣喘,對於合併肥胖的氣喘患者也能展現療效,為這類患者帶來全新的治療希望。年輕媽因氣喘發作常跑急診 新一代生物製劑助控制氣喘台大醫院雲林分院胸腔內科主治醫師陳彥甫分享,臨床上曾遇到一名30多歲的年輕媽媽,體重約90公斤,屬於第二型嚴重氣喘患者。她幾乎每個月都因氣喘急性惡化頻繁前往急診室,主要症狀包括不斷咳嗽、痰多、喘息以及嚴重胸悶。特別是在生完孩子後,因孩子經常感染感冒,她也經常被傳染,進一步加重了氣喘症狀。治療過程中,她甚至一度需要依賴全身性類固醇來控制病情。考量到這名患者合併肥胖、鼻瘜肉,以及影像學檢查顯示多處黏液栓塞(mucus plugging)的情況,陳醫師為她申請了新一代生物製劑的健保給付。在接受治療一個多月後,患者的類固醇使用量逐漸減少,氣喘症狀也得到了顯著控制,不僅緩解了不適,還大幅提升了生活品質。陳醫師進一步指出,目前市場上的嚴重氣喘生物製劑均已通過嚴格的臨床試驗,證實其療效與安全性,並經由政府機構審核取得藥品許可證。然而,患者在接受治療時仍需留意可能出現的不良反應,例如注射部位的腫脹或疼痛。若發生疑似藥物副作用,應儘速尋求專業醫師的協助。新一代生物製劑擴增給付條件 嚴重型氣喘患者新福音目前健保對於嚴重氣喘生物製劑治療的給付條件仍存在一些限制,在臨床運用上可能帶來挑戰。台大醫院雲林分院胸腔內科主治醫師陳彥甫指出,有些生物製劑其健保給付規定要求患者必須使用半年以上的口服類固醇才能申請。然而,類固醇治療對部分患者可能引發不適的副作用,例如肥胖、水腫、血糖難以控制、骨質疏鬆,甚至增加感染風險,對患者的身心健康造成一定影響。為了幫助更多嚴重型氣喘患者,健保今年進一步擴增了對新一代生物製劑的給付條件,為患者提供了更多治療選擇。陳醫師強調,透過早期使用生物製劑來有效控制氣喘症狀,不僅能減少口服類固醇副作用的累積,也能顯著提升患者的生活品質。這樣的治療策略更加貼近臨床需求,為患者帶來更大的希望。控制氣喘不二法門 遵循醫師指示規律用藥「近幾年隨著更多新型生物製劑的問世,醫師在臨床治療上多了強有力的武器,能更有效地控制嚴重型氣喘。」陳彥甫醫師表示,生物製劑的進步,確實為不同嚴重型氣喘患者的治療帶來了顯著突破。然而,想要真正有效控制氣喘,關鍵仍在於患者是否能遵循醫師指示規律用藥,並結合戒菸、適當減重、規律運動,以及減少暴露於過敏原的環境,才能有效預防不可逆的肺部損傷。陳醫師進一步指出,生物製劑作為過去10年來嚴重氣喘的新型治療選擇,已有大量研究證實其對疾病控制的效果。然而,若患者中斷治療,氣喘相關的生物標記指數可能逐漸回升,並增加症狀惡化的風險。因此,他建議尚未完全控制氣喘的患者,應每3~6個月由醫師評估治療反應,根據病情調整氣喘藥物及生物製劑的使用方案,以確保疾病穩定。「氣喘雖然無法完全痊癒,但只要規律用藥,就有機會達到臨床緩解,並有效避免疾病進一步惡化。」陳彥甫醫師強調,規律用藥與持續治療是氣喘管理的核心,患者應積極配合醫師的治療建議,進而改善症狀,提升生活品質,重回正常生活。

新藥解盲兩樣情!康霈跳空漲停重登股后 順藥大股東砸錢救火止跌回升
台股12日收在23,046.80點,上漲了143.17點,漲幅達0.63%;其中,友華漲幅達10%居本日排行榜之冠,緊跟在後的是昨晚公布局部降脂新藥CBL-514美澳臨床二期試驗解盲達標的康霈,股價飛漲了52元、高達9.98%,跳空漲停573元,重登生技新藥股股后。相對順藥在11月29日宣布治療急性缺血性腦中風新藥LT3001,第二期臨床試驗結果數據達初步療效的訊息,卻未受投資人買單,股價大跌40%多,讓大股東晟德製藥宣布10日起砸10億元買回順藥股票,股價雖止跌回升,今天股價收在193.5元,上漲了3.00元,漲幅達1.57%。二家新藥股解盲消息公布之後,投資人給予兩極化反應,市場熱議其一關鍵是在於所公布的「P值」,是否有清楚揭露受試者、安慰組的療效差異的數據,以及療效效果的說明。康霈生技11日晚間正式公布其505(b)(1)全新小分子新藥CBL-514注射劑用於局部減脂之Phase 2b臨床試驗(CBL-0204 Phase 2b)最終統計結果。康霈也將於後續召開線上法說會,詳細說明該試驗臨床試驗數據與成果。其中,在具有治療前與至少一次治療後數據的受試者(FAS)中,臨床試驗主持醫師以腹部脂肪堆積等級量表(CR-AFRS, Clinician Reported -Abdominal Fat Rating Scale)評估,76.7%的受試者經CBL-514治療後可顯著改善至少1個等級,對比安慰劑組之18.9%,療效達統計上顯著差異(p=0.00004),本試驗主要療效指標成功達標,且整體藥物安全性與耐受度表現良好。(符合試驗規範之受試者Per-Protocol:81.8%的CBL-514用藥受試者改善至少一個等級之CR-AFRS。)在此試驗告捷後,CBL-514可望於2025年進入全球多國多中心三期樞紐臨床試驗(Pivotal Phase 3 Study),將有機會成為全球第一個可用於大範圍局部減脂的新藥。該試驗次要療效指標之FAS統計結果顯示,最後一次治療後12週,試驗主持醫師評估中,32.0%的CBL-514用藥受試者改善至少二個等級之CR-AFRS,顯著高於安慰劑組的 0%(p=0.00122)。最後一次治療後12週,受試者自我評估中,76.7%的CBL-514用藥受試者改善至少一個等級之PR-AFRS,顯著高於安慰劑組的19.4%(p=0.00004)。(符合試驗規範之受試者Per-Protocol:81.8%的CBL-514用藥受試者改善至少一個等級之PR-AFRS。最後一次治療後4週,50%的CBL-514用藥受試者腹部皮下脂肪體積減少至少20%,顯著高於安慰劑組的 0%(p< 0.00001)。最後一次治療後4週,與安慰劑組相比,CBL-514組腹部皮下脂肪厚度可減少27.1%(95% CI: -32.3%, -21.8%, p< 0.00001),療效達到統計上顯著差異。58.8% 的CBL-514組受試者僅需接受一次治療,即可達到至少一個CR-AFRS等級的改善。安全性方面,受試者完成至多4次CBL-514療程後的整體安全性與耐受度良好,主要不良事件為常見的輕度和中度的注射部位反應(injection site reaction)。

急砸10億救火!順藥連吞6跌停板止血 10日股價回漲快8%
台股10日收在23,125.08點,下跌了148.17點,跌幅達0.64%;生技新藥股中近期以「順藥」連吞6根跌停板的為最火熱話題,但在大股東晟德製藥公布準備10億元買回順藥股票消息之後,今天股價止跌回升到漲停收在208.0元,上漲了15.00元,漲幅達7.77%,本日交易量達4,640張,較昨的156張29.7倍。不過,順藥(6536)在解盲前、今(2024)年10月28日最高開出400元,卻在11月29日根據中國大陸授權合作夥伴上海醫藥公司公告,治療急性缺血性腦中風新藥LT3001,第二期臨床試驗結果數據達初步療效的喜訊。投資人卻不買單,從12月2日起恢復交易連跌停板,股價由361.0元一路掉到昨收盤的193元,短短的六個交易日重挫了168元、跌幅達46.5%。晟德(4123)在12月9日晚間宣布,晟德董事會決議暫訂在12月10日起至2025年1月10日期間,購買順天醫藥生技股份有限公司股票,董事會授權董事長王素琦,於每股價格新台幣150元至225元間,總金額新台幣10億元額度內,視資本市場狀況,於證券交易公開市場購買順藥股票。晟德累計持有順藥59,566,048股~ 61,788,270股,累計金額新台幣 23.36億元,持股比例35.27%~ 36.58%;子公司玉晟管顧截至2024年12月9日止,累計持股數量為1,053,218 股、累計金額 3168.3萬元,持股比例0.62%。順藥也發布重訊就投資人關注順藥公司授權中國夥伴上海醫藥於中國執行之二期臨床試驗解盲結果未揭露試驗數據、公告P值以及未來試驗數據的發表計畫,進一步予以說明三點。順藥強調尚未取得上海醫藥提供的完整臨床試驗報告,目前僅掌握試驗數據資料的所有權歸屬於上海醫藥,因其商業考量,尚未同意揭露相關資訊。因此,在未獲上海醫藥同意的情況下,無法擅自公開試驗數據,未來亦將依上藥規劃與通知,公告相關詳細數據。

健保延長新一代口服荷爾蒙治療年限!高風險轉移性攝護腺癌患者治療更有保障
【健康醫療網/林韋彤、林宗憲報導】根據衛生福利部最新統計,攝護腺癌已攀升至112年十大癌症死因的第五名,其中有三成患者在確診時已出現癌症轉移。三軍總醫院泌尿外科主治醫師楊明昕指出,臨床上通常會透過抽血檢測患者的攝護腺特定抗原指數(Prostate Specific Antigen,簡稱 PSA),若指數異常偏高,可能代表罹患攝護腺癌,需進一步安排相關檢查。然而,由於攝護腺位置深藏於肛門與直腸之間,且早期症狀如頻尿、排尿困難等,與良性攝護腺肥大相似,民眾往往難以察覺病情,導致許多患者錯失早期治療的機會。楊明昕醫師表示,不少患者因症狀輕微而延誤就醫,直到骨痛或其他不適出現時,才確診為高風險晚期癌症。這也讓癌症治療的挑戰更加嚴峻,尤其是對於已出現癌細胞轉移的患者,治療手段的選擇與效果成為重要的課題。健保放寬給付條件!高風險轉移性攝護腺癌治療年限延長至三年自113年8月1日起,針對高風險轉移性攝護腺癌患者的新一代口服荷爾蒙治療藥物,健保給付年限由原本的兩年延長至三年,這項政策改變讓許多患者受惠。對於因健保限制而停藥的患者,只要經專業醫師評估後,於三個月內未出現病情惡化,便可申請續用一年。楊明昕醫師說,過去許多患者在兩年療程結束後,不得不中止用藥,這對病情控制造成很大影響。如今隨著健保政策的擴大,他們能夠再次申請治療,延續使用新一代口服荷爾蒙藥物。楊醫師進一步指出,這類藥物的費用動輒每月上萬元,對許多患者來說,健保的支持大大減輕了經濟負擔,也讓治療得以繼續,抑制腫瘤的進展,為患者爭取更長的生命時間。他強調,這項政策對患者及其家庭意義重大,不僅提升了生活品質,也帶來更多希望。新一代荷爾蒙治療突破抗藥性挑戰!直接作用於腫瘤細胞傳統荷爾蒙治療主要透過針劑注射,抑制腎上腺素或睪丸分泌雄性素,以阻斷癌細胞的生長。然而,當癌細胞進展至去勢抗性階段時,腫瘤的抗藥性問題會讓治療效果逐漸減弱,存活期通常縮短至不到四年。楊明昕醫師表示,新一代口服荷爾蒙治療藥物能直接針對腫瘤細胞的雄性素受體,從根本抑制癌細胞的增長與擴散,並有助於縮小腫瘤體積。根據大型臨床試驗數據顯示,這類藥物可有效降低33%的死亡風險,將患者的整體存活期可額外增加三年以上,為高風險轉移性攝護腺癌患者帶來治療新契機。三大指標 定義高風險轉移性攝護腺癌高風險轉移性攝護腺癌患者的分類,有助於醫師提供更精準的治療策略。楊明昕醫師說,目前主要依據以下三大指標:1. 葛里森指數超過8分:代表腫瘤病理分化差,癌症侵略性高。2. 骨轉移三處以上:尤其是非脊柱或非骨盆腔的骨轉移,顯示癌症擴散範圍較廣。3. 內臟轉移:如肺部或肝臟遭癌細胞侵襲,表示病情已相當嚴重。當患者符合以上三項指標中的任兩項時,則歸類為高風險轉移性攝護腺癌,需採取更積極的治療方式,以提升存活機率,延長生命時間。規律運動與健康管理 是長期抗癌的重要關鍵楊明昕醫師提醒,接受荷爾蒙治療的高風險轉移性攝護腺癌患者可能會出現疲累、骨痛或骨質疏鬆等副作用,建議患者每天進行適量的運動,例如散步或簡單的伸展運動,有助於維持體能與心理健康;此外,均衡飲食和規律作息也是抗癌過程中的重要關鍵。楊明昕醫師強調,除了藥物治療,患者的生活管理一樣重要。透過規律的健康習慣,不僅能提升治療效果,還能幫助患者穩定情緒。他呼籲民眾,若有疑似症狀,應儘早就醫檢查,早期發現、早期治療,為自己的健康多爭取一份保障。

順藥連吞5根跌停板、晟德也跟跌 三點緊急說明未公布試驗數據原因
晟德(4123)和旗下的順藥(6535)11月29日起才因公布新藥LT3001臨床結果,符合重大資訊標準,二檔股票停牌暫停交易,各分別收在50.6元、361.0元;12月2日起恢復交易,順藥卻連著五天苦吞跌停板,本周跌幅40.7%,交易總量約3591張。順藥6日收在214元,單日跌幅達9.89%,成交量158張,一周以來股價下跌147元,;晟德今收在43.65元,下跌0.65元,跌幅達1.47%,交易量 2,885張;一周以來股價下跌6.95元,周跌幅為13.7%。晟德順天醫藥生技(6535)於11月29日公布,根據中國大陸授權合作夥伴上海醫藥公司公告,治療急性缺血性腦中風新藥LT3001,第二期臨床試驗結果數據達初步療效;未來將積極推進與國際藥廠的授權洽談,加速全球開發計劃的進展。股價卻未因該項臨床試驗公布結果相對反應,順藥也發布重訊就投資人關注順藥公司授權中國夥伴上海醫藥於中國執行之二期臨床試驗解盲結果未揭露試驗數據、公告P值以及未來試驗數據的發表計畫,進一步予以說明三點。首先就「關於試驗數據揭露說明」,順藥表示,公司尚未取得上海醫藥提供的完整臨床試驗報告,目前僅掌握試驗數據資料。由於中國地區授權上海醫藥進行相關業務,公告內容需與上海醫藥公告一致。試驗數據的所有權歸屬於上海醫藥,因其商業考量,尚未同意揭露相關資訊。因此,在未獲上海醫藥同意的情況下,本公司無法擅自公開試驗數據。有鑑於此,本公司已於接獲上海醫藥試驗結果,立即依據上海醫藥通知與公告內容,召開重大訊息記者會以及法人說明會揭露訊息。未來亦將依上藥規劃與通知,公告相關詳細數據。在「未公告P值的原因說明」,順藥表示,本試驗為本公司首次進行多劑量第二期劑量探索研究,旨在評估藥物的安全性及探索有效劑量,主要目標為確認試驗藥物的耐受性及劑量範圍,試驗結果已達成設定目標並顯示良好耐受性。由於第二期試驗以探索性研究為主,依據藥品優良臨床試驗規範以及本試驗之統計分析計畫書,本試驗對於療效部分並未定統計假設,故無對應之療效統計 P 值,以符合國際相關法規規範。LT3001 作為全新作用機轉的新分子藥物,其與對照組在療效指標上的差異於試驗前屬未知,因此試驗設計未包含 P 值分析。為進一步探索相關療效,本公司正積極著手規劃第三期臨床試驗,以確定療效及對應的統計顯著性,並作為支持藥證申請的重要數據參考。在「未來試驗數據發表計畫說明」部分,順藥指出,未來試驗數據的發表計畫,將依上海醫藥的規劃進行。本公司雖因上海醫藥的綜合考量而未能即時公告試驗數據結果,但此情況不影響後續開發計畫的進行。本次試驗結果為支持未來開發的關鍵數據,順藥將依據現階段中國二期臨床試驗與多國多中心二期臨床試驗結果,綜合評估,審慎規劃三期臨床試驗之進行,此試驗結果之價值與運用並不受公告與否影響。順藥表示,傳統溶栓藥 rt-PA 因出血風險,僅限於中風後 4.5 小時內使用,治療時間窗極短,最新數據顯示 LT3001 對中風發作後達 24 小時內病患,展現改善神經功能潛能,且不增加出血風險,有機會顛覆黃金 4.5 小時定律,改寫中風治療史。順天醫藥生技股份有限公司根據中國授權合作夥伴上海醫藥公司之公告宣佈,LT3001在中國進行的二期臨床試驗結果,給予反應。此臨床試驗由上海醫藥在中國執行並順利完成,針對急性缺血性腦中風患者給予LT3001,評估其安全性和有效性,為後續的臨床開發提供關鍵數據支援。該臨床試驗設計於中國執行,為一項多中心、隨機、雙盲、安慰劑平行對照的二期臨床研究,總共納入300名急性缺血性腦中風患者。主要目的是評估多次給予LT3001後的安全性,包括首次給藥後90天內的不良事件和不良反應的發生率,包括首次給藥後3天內發生症狀性顱內出血、無症狀性顱內出血的受試者例數及發生率。次要目的是評估使用該藥物治療後第90天之日常生活功能改善,以功能評估量表(mRS)達到 0-1的比例做為評估指標。試驗結果安全性方面顯示,LT3001注射液總體安全耐受性良好。首次給藥後90天內的不良事件和不良反應的發生率在高劑量LT3001組、低劑量LT3001組和安慰劑組類似,且絕大多數為輕中度。三組均未發生症狀性顱內出血,僅3例受試者發生無症狀性顱內出血,且均發生在安慰劑組。療效指標方面,LT3001注射液在治療後第90天mRS達到 0-1的受試者比例上顯示出了初步療效。

醫療科技展AI成亮點 經長郭智輝:大健康產業規模10兆元
台灣醫療科技展5日在南港展覽館舉行開幕典禮,立法院長韓國瑜向來自全球300多位外國代表喊話,表示台灣醫療技術太棒,但全世界知道的人太少,建議明年應成為醫療「走出去」元年,且外交部應有具醫療背景的次長,將醫療、外交、經濟緊密結合。經濟部長郭智輝也表示,大家都想要健康長壽,所以值得跨產業合作、全力以赴,這將是規模超過十兆的大健康產業鏈。生策會會長翁啟惠表示,這是全世界獨一無二、以醫院為核心的展會,結合醫療生技與資通訊領域,已吸引15萬人次參觀。近來因AI技術發展,台灣在AI布局超過20年,加上台灣的醫療指數是世界第一,擁有全球最完整的健保資料庫,也已建立新的人體生物資料庫,如果結合AI來處理與分析醫療大數據,將開發更精準、有效率的早期預防與檢測創新產品;未來台灣生醫產業也將從疾病治療為重心,拓展至涵蓋更前端的精準預防與健康促進。翁啟惠表示,台灣在新藥領域已成功開發10多項國際上市新藥,透過AI賦能加速新藥設計、合成和生產製造到臨床前及臨床試驗等。郭智輝表示,這一屆內閣成員的目標是希望未來八年,可讓國人平均餘命提升到83歲,同時也要讓國人活得健康,能走、能動、健康的長壽,隨著AI的快速發展,智慧醫療是各國爭相投資的重點專案,從藥物開發到病情診斷、分析治療,甚至於健康照護、醫務管理等,AI將大幅的改變醫療科技的面貌。郭智輝表示,台灣應運用AI與ICT等技術優勢,發展智慧醫療、醫美健檢、保健食品、運動科技產業等,輔導企業往高附加價值產品與服務,生技健康產業規模將超過10兆元,預期在結合科技、醫療優勢下,將可成為另一個護國群山。

順藥報喜 腦中風新藥大陸二期臨床試驗成功
晟德(4123)旗下的順天醫藥生技(6535)29日公布,根據中國大陸授權合作夥伴上海醫藥公司公告,治療急性缺血性腦中風新藥LT3001,第二期臨床試驗結果數據達初步療效;未來將積極推進與國際藥廠的授權洽談,加速全球開發計劃的進展。晟德和順藥因公布新藥LT3001臨床結果,符合重大資訊標準,28日起股票停牌、暫停交易。截至收盤,晟德、順藥分別收50.6元、361.0元。展望後市,因法說會報喜下週股價望見紅收高。新藥解盲成功,將為全球中風治療領域帶來革命性突破。順藥總經理葉聖文在法說會上表示:「全球每4人就有1人中風,很小的血栓就會造成全身很大的傷害,但打通血管的手段30年來只有2個,使用靜脈血栓溶劑蛋白藥有出血風險,就算利用影像拿出血栓,不到一半的病人能恢復生活正常。」順藥表示,傳統溶栓藥 rt-PA 因出血風險,僅限於中風後 4.5 小時內使用,治療時間窗極短,最新數據顯示 LT3001 對中風發作後達 24 小時內病患,展現改善神經功能潛能,且不增加出血風險,有機會顛覆黃金 4.5 小時定律,改寫中風治療史。順藥在中國展開第二期臨床試驗,為一項多中心、隨機、雙盲、安慰劑平行對照的II期臨床研究,共納入300名急性缺血性腦中風患者。主要評估多次給予LT3001後的安全性和有效性,包括首次給藥後90天內的不良事件和不良反應的發生率,包括首次給藥後三天內發生症狀性顱內出血、無症狀性顱內出血的受試者例數及發生率。次要目的是評估使用該藥物治療後第90天之日常生活功能改善,以功能評估量表(MRS)達到0-1的比例做為評估指標。試驗結果顯示安全耐受性良好,為 LT3001 在急性缺血性腦中風領域的後續開發奠定關鍵數據支持。

健保署預告2子法解決缺藥危機 盼農曆年後上路
國人用藥高達7成仰賴進口藥,大多來自中、印,一旦國際局勢改變,藥品將面臨斷鏈危機。健保署為此鼓勵「國藥國用」,也鼓勵新藥儘早進入台灣,今預告兩項子法。未來新藥若在國際上市的2年內進入台灣,將比照首發新藥給予優惠核價。另為讓市面上的選擇更多,逾專利期5年內前2家學名藥、生物相似藥,核價最高可比照原廠藥。使用國內原料藥在地製造的藥品,核價可加算1成,最高3成。新制1月20日預告期滿,若無異議,最快年後上路。健保署醫審及藥材組組長黃育文表示,為鼓勵新藥儘早進入台灣,健保署釋出政策利多,擴大鼓勵國內藥廠製造創新藥品,凡是在國際上市許可2年內的新藥,或是十大先進國家核准上市滿5年的新藥,雖然台灣不是全球首個上市點,但為鼓勵儘早輸台,將可比照首發新藥,給予優惠核價。近年國內爆發缺藥潮,甚至成分單純的輸液也缺,還得仰賴國外進口。黃育文認為,藥品不能「一家供應全部」,必須要讓市面上的選擇多一些,因此原廠藥逾專利期5年內,首2張取得藥證的國產學名藥、生物相似藥,也能得到優惠價,最高可與原廠藥相同,這是為讓藥廠別拖太久,趕快上。另為鼓勵在地製造,黃育文表示,凡是國內生產的原料藥,或國內安全性臨床試驗獲國際學術期刊發表且增列於仿單上,以及最早向主管機關為P4專利聲明且獲准核發藥證的學名藥,只要符合其中一項條件,未來健保核價任一皆可加算1成,最高3成。為確保供藥穩定,合理保障藥價,只要同時符合主管機關公告的必要藥品、同分組內有國內製造品項、同分組分類未逾3品項的條件,當年度藥價將不予調整。目前健保署已推動平行審查、主動收載藥品機制,並鬆綁書面申請文件相關規範,期盼提升國人用藥可近性,加速新藥納入健保。學名藥協會理事長陳誼芬感謝政府踏出關鍵的第一步,相信新制可實質鼓勵國內製藥產業持續創新研發新藥,也能帶動學名藥品質的保證,讓廠商更有向上提升的動力。她相信這對國人用藥權益、國內生技製藥產業都有正面幫助。

首款失智症藥物審查通過 醫:可真正減緩或停止退化
全台失智症人口逐漸上升,衛福部及台灣失智症協會今日(19)辦理失智症防治照護政策綱領成果發表會,台灣失智症協會理事長徐文俊表示,近日通過台灣食藥署審查的阿茲海默藥物,是20年來首款,且不同於過往的症狀治療,是真的可以減緩甚至停止病理變化,改善病程進行治療的藥物,為重大突破。衛福部次長呂建德說,未來將和健保署討論,盼推動相關藥物給付。根據衛福部今年「全國社區失智症流行病學調查」結果,全台65歲以上長者失智症盛行率近8%,失智類型以阿茲海默型最多,占56.88%。徐文俊說,此款單株抗體藥物已經於去年7月在美國通過上市,適用罹患阿茲海默症的輕度認知障礙或輕度失智患者,並於近日通過台灣食藥署審查。徐文俊表示,上次出現阿茲海默症藥物是在2013年,只能針對症狀治療,而此款新藥將能實際改善病程,透過靜脈注射打到體內後,可移除大腦中的類澱粉沉澱,達到停止或延緩病理變化效果;臨床試驗發現,每兩周施打一次,用藥18個月,可延緩5到7個月的退化,部分個案甚至可完全移除類澱粉沉澱,雖無法挽回已經凋零、死亡的細胞,但可以延緩其他神經元死亡。徐文俊解釋,此類藥物適用患者,必須先確診阿茲海默症,且其嚴重程度範圍在輕度認知障礙到輕度失智,失智症太嚴重或沒有症狀者不建議使用。不過他提醒,藥物還是有副作用可能,基本上包括水腫,嚴重可能出血,使用上仍要小心。此藥使用條件,徐文俊說明,須先經過腦脊髓液檢查或類澱粉正子攝影,檢查類澱粉沉積、確診阿茲海默症,再進行測驗評估症狀嚴重度;並還需要做基因檢測驗APOE4基因。目前檢測與藥物都要自費,以美國價格預估人年藥費約新台幣70萬元,類澱粉攝影則約7萬元。徐文俊指出,新藥出現後,整個社會對失智症、阿茲海默症看法將大幅改變,人們可以不用再害怕檢查,因為「阿茲海默不是絕症」。
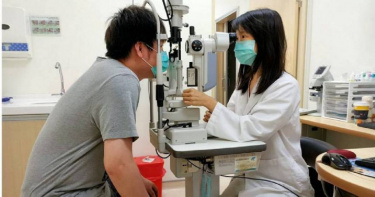
乾眼症患者10年增7成 「全球首款鼻噴液藥」將在台上市
全世界首款以鼻噴給藥方式治療乾眼症的星特潤®TYRVAYA®乾眼症噴鼻液,已獲得衛福部食藥署的新藥取證通知,這是東生華(TW-8432)今年內成功取得的第二個藥品上市核可。東生華總經理楊思源表示,星特潤®TYRVAYA®於2021年通過美國食品藥物管理局(FDA)新藥許可證並成功上市,這款由美國製藥公司Oyster Point Pharma研發的新藥,將為台灣乾眼症患者帶來突破性的治療選擇。去年,東生華通過與箕星藥業的策略合作,迅速展開星特潤®TYRVAYA®在台灣的查驗登記與商業化運作,歷經不到一年即取得藥證。乾眼症是一種複雜且多因素導致的眼表疾病,表現為淚膜受損,嚴重影響患者的生活品質。東生華所推出的星特潤®TYRVAYA®,屬於一種高選擇性的膽鹼受體促效劑,可促進天然淚液的分泌。在臨床試驗中,參與的1403名乾眼症患者在使用星特潤®TYRVAYA®兩週後,症狀和癥兆即有所改善,持續使用四週後,天然淚液分泌量仍顯著增加。楊思源總經理引用《財富商業洞察》(Fortune Business Insights)的數據指出,全球乾眼症治療市場預計在2030年將達到113億美元,預測年複合成長率為7%。而根據台灣衛福部的資料統計,全台乾眼症門診就醫人數在近10年間激增七成,顯示市場需求日益攀升。

藥華藥完成ET全球三期臨床試驗明年初解盲 林國鐘:盼造福罕見血癌患者
藥華藥(6446)今天(12日)宣布旗下新藥Ropeginterferon alfa-2b(簡稱Ropeg,即P1101)之原發性血小板過多症(ET)全球多國多中心第三期臨床試驗(簡稱SURPASS ET)的最後一位受試者完成試驗,預計2025年初取得並公布評估指標之統計結果;之後將準備送件申請臺灣、美國、日本、韓國及中國大陸等多國ET藥證,有望成為未來營運加速成長的第二引擎。藥華藥今天以622元作收,下跌12.00元,跌幅達1.89%。10月營收9.1億元,年增67%,10月營收以罕見血癌新藥Ropeg的美國銷售為主,美國及日本市場業績持續成長。2024年累計營收已達75.9億元,年增89.40%。藥華藥執行長林國鐘表示,美國FDA自1997年以來已有20多年未批准治療ET的新藥上市,FDA正式批准Ropeg進行用於治療ET的第三期臨床試驗已令人十分振奮,如今完成試驗更是達成一重大里程碑。Ropeg已讓全球許多PV患者受惠,同時擁有持續擴展用於更多適應症的可能性,我們有信心Ropeg可以造福更多MPN患者。Ropeg 為藥華藥自行研發生產之新一代創新長效型干擾素,至今已獲全球約40個國家核准用於成人真性紅血球增多症(PV)患者,包括美國、日本、中國及歐盟等主要新藥市場。ET與PV同為骨髓增生性腫瘤(MPN),病人數亦相近。目前ET主要用藥是仿單標示外的愛治(HU),但研究顯示,2成ET 患者對HU不耐受或產生耐藥性;第二線用藥則是安閣靈(Anagrelide),也是唯一獲FDA核准的ET用藥,用於HU無效或無法忍受其副作用的病患。因Ropeg用於PV的臨床試驗結果正面,藥華藥遂與FDA會議討論後啟動SURPASS ET臨床試驗,以比較Ropeg與安閣靈用於ET的療效、安全性與耐受性,收案範圍含括美國、日本、台灣、韓國、香港、中國、新加坡與加拿大,共收入174位受試者。另外,Ropeg於美國及加拿大進行的無對照組之單臂臨床試驗EXCEED ET臨床試驗也已收案完成,在醫師與病人的熱烈迴響下收案踴躍,在不到一年的時間內收案人數迅速超過原訂目標的64人,為控制收案人數才截止收案於91人,高達原訂收案目標的142%,顯示臨床研究機構對Ropeg顯著療效和安全性的高度關注,預計將非常有助於未來申請ET藥證。藥華藥預計2025年年初獲SURPASS ET臨床試驗評估指標之統計結果,之後將準備送件申請全球多國ET藥證,現正積極投入行銷前準備。Ropeg上市銷售至今已造福全球上萬名PV病患,推動藥華藥營收每季穩健增長,成績亮眼。未來Ropeg獲各國ET藥證後,有望成為藥華藥衝刺業績成長又一強大動能。

挑戰三萬點1/台股川普當選慶祝行情 「這個時間點之後……」半導體股再前進
美國新任總統川普當選,全球股市最大不確定因素排除,台股從11月初開始提前反映慶祝行情,8日收盤23553點。面對川普2.0明年開新局,台股將如何行?CTWANT採訪多名重量級分析師董座,他們皆認為挑戰新高24416點將屆,三萬點可望在2025年見曙光,有多頭總司令封號的國泰投信董座張錫更喊出,台股將邁向三萬點且「不用預設高點!」台美股有高度連動性,今年美國大選更是牽動大盤走勢。台股在AI浪潮助攻下,今年一路走高,7月11日創下歷史新高24,300點,川普13日中槍後,台股也從高點墜落,隨投票日逼近,川普民調領先,市場跟著提前反映,大盤從11月1日的22780點起漲,六個交易日漲了773.89點,8日收在23553.89點。川普6日當選美國總統重返白宮前,川普一席對台半導體關稅政策發言,牽動台股大盤拉回,「可以看到投資人也在調節部位,先部分的獲利了結。」台新投顧副總黃文清表示,川普勝選後,台股短期可能大幅震盪,直至2025年1月20日就職前仍瀰漫不確定因素,「當新總統要執行的政策方向較明確與底定時,台股的反應即會更加明顯。」國泰投信董事長張錫,預測台股將邁向三萬點。(圖/CTWANT資料)第一金投顧董事長陳奕光接受CTWANT採訪時具體指出,「2024年會先過24000點,到明年第一季會挑戰24416點歷史新高,一路走升到第四季的26000點。」至於何時會來到3萬點?陳奕光說,「就這幾年了!」「要走到30000點,單看台積電的加權指數的貢獻的話,股價要漲到1500元。」陳奕光並進一步分析,「回歸基本面,台股上市櫃公司今年的獲利將創新高直逼4兆元,明年還挑戰4.3兆元,AI趨勢不變,半導體、電子業、機器人AIOT等連結應用面、比特幣等相關硬體設備等,皆受惠。」資深證券分析師杜金龍也認同台股補升點挑戰24416點之外,還預測到「2025年就會走到3萬點,甚至還會持續到33000點、38000點……。」他補充說,AI會至少讓台股五年之內好,看看台積電都漲這麼多,還會再攀升的。華南投顧董座儲祥生則告訴CTWANT記者,「川普當選後到明1月就職的這段期間,台股會有一段慶祝行情」「現在百業情況仍遭,唯有AI強,就看NVIDIA財報,先過了24416點再說。」他認為從 25000點往30000點,若高估台積電的貢獻點,股價升漲超過本益比22倍,「還是要看看川普就任後的政策,美國的通膨變化。」台積電的獲利表現與股價漲幅,將為台股挑戰創新高的關鍵。(圖/記者黃耀徵攝)台股能否順利挑戰24000多點,台新投顧副總經理黃文清表示,從川普選前公開談話,整理出重點包括「增加半導體關稅、取消美國廠補助、要求台積電增設廠、支付更多國防支出、中國大陸台商供應鏈移轉、降美稅有利美國內需」等,對台股中的半導體、電動車個股影響較大,而在軍工、航太類股、美國內需股、工業機器人、石化、鋼鐵業等,則是利多產業。黃文清分析,半導體今年已漲多,目前台積電、聯發科、台達電等處於高檔震盪,原物料像是台塑、中鋼等石化鋼鐵相對抗跌,金融股則為穩盤工具,進可攻退可守,受惠降息開啟循環,有利壽險投資債券市場,對於富邦金、國泰金、凱基金、中信金等具有大型壽險公司的金控股是利多,「市場也在關注富邦金股價何時來到100元大關。」至於到2025年春節過年前,投資人還可關注那些題材?黃文清建議,受到燃用油價跌,且是賞楓、滑雪、過節的旅遊觀光旺季,航空、觀光、餐飲股等受惠;新藥製藥研發等生技類股在各類股輪動中也會因臨床試驗等結果揭曉而有表現;且看好消費性類股進一步上揚,包括紡織、自行車、運動休閒類股。

CAR-T細胞免疫治療給付滿周年 共45人通過「3.7億藥費健保來幫忙」
自去(112)年11月後,健保署將CAR-T細胞免疫治療納入健保已滿一週年。健保署石崇良署長說,「成人之瀰漫性大B細胞淋巴瘤」或「25歲以下急性淋巴性白血病」兩疾病,患者若經過兩線標準治療後,仍治療反應不佳或復發,即有機會符合CAR-T細胞免疫治療的給付標準,全台約100位癌友符合資格。根據健保署資料,今年有60人申請,健保過件率高達75%,共有45人成功通過,包含39例瀰漫性大B細胞淋巴瘤、6例兒童或青少年急性淋巴性白血病,每人819萬、共計約3.7億的醫療費用由健保支付。截至目前為止,已有33位患者已完成治療,包含29例瀰漫性大B細胞淋巴瘤、4例兒童或青少年急性淋巴性白血病。讓各界更雀躍的是,已使用CAR-T細胞免疫治療的患者,至今均維持良好的疾病控制。「感謝健保署與專家理解治療的急迫性,持續加速審查進度,從送件至核准平均僅要一至兩週,傾盡全力幫助癌末患者爭取治癒」,中華民國血液病學會柯博升理事長也鼓勵:「未能成功申請健保的個案,多是經過評估後,患者仍可進行異體幹細胞移植,尚不需使用CAR-T細胞免疫治療;另外則是檢附資料不全,待補齊資料後即可再次申請,千萬別氣餒!」「健保給付通過後,自費藥價也大幅降低」,中華民國血液及骨髓移植學會李啟誠理事長接續分享:「國際間CAR-T細胞免疫治療單次費用要價1200萬至1500萬不等,在台灣自費治療有望減少680萬藥費,降價幅度高達45%;再加上台灣血液疾病治療經驗成熟,從檢測、治療可完善提供治療後的各種副作用控制與照護,更是吸引了各國患者特地到台灣治療。」以花蓮慈濟醫院為例,今年就各有一位七十歲瀰漫性大B細胞淋巴瘤患者以及十四歲急性淋巴性白血病癌童,特別從越南飛來台灣自費治療,無疑帶動了我國國際醫療發展,讓台灣的血液癌症治療持續於國際間發光。中華民國血液病學會副秘書長暨臺大癌醫中心醫院血液腫瘤部主治醫師劉家豪副秘書長指出,國健署《民國110年癌症登記報告》顯示,白血病與非何杰金氏淋巴瘤兩疾病,在男性、女性癌症發生與致死排行中排名均為第九與第十名,可見得這兩種癌症不僅發生率不容小覷,也嚴重威脅了國人性命。在這兩個疾病當中,又以急性淋巴性白血病與瀰漫性大B細胞淋巴瘤為常見的類型。前者好發於兒童,後者則好發於中高齡者。雖然兩疾病發病初期症狀不典型,容易與疲勞、生長痛、腰痠背痛混淆,但事實上,病程可能惡化的極為快速,未即時就醫治療,可能在短短幾週、幾個月就會危及性命。劉家豪醫師進一步說明,確診後患者與家屬也不用過於擔心,根據臨床經驗統計,在第一線的高劑量化療合併標靶藥物療程後,約有8至9成急性淋巴性白血病與6至7成瀰漫性大B細胞淋巴瘤患者,疾病可獲得長期控制。劉家豪醫師說,急性淋巴性白血病與瀰漫性大B細胞淋巴瘤一旦第一線治療復發或是反應不佳,患者的治療就會變得相當棘手,壽命也將陡坡式下降。舉例而言,約有2成兒童急性淋巴性白血病患者,會在第一線治療失敗或復發,而這群病患高達5至7成的癌童活不過五年,多數的癌童還是來不及長大。若檢視瀰漫性大B細胞淋巴瘤,約一半病患在第一線化療後復發或無效,此時這群病患更是有高達7至8成難以存活超過五年,此類醫學困境一直難以克服。劉家豪醫師鼓勵,近年來CAR-T細胞免疫治療問世,這種集結了基因、細胞、免疫治療等醫療科技於一身,屬於一種藥品,經過多國的大型臨床試驗,在治療成效與安全性上有保障。劉家豪醫師指出,CAR-T細胞製作需要先分離患者免疫細胞中的T細胞,再送往國外實驗室植入可以追蹤癌細胞標的的基因序列,將原本如同「普通士兵」的T細胞,轉變成有如「精銳兵」會辨認癌細胞標的之CAR-T細胞,並透過大量複製,打造一支可以精準殺滅癌細胞的戰隊。將這些CAR-T細胞回輸患者體內後,這群「精銳部隊」還可以在人體內生長,因此可以透過一次性治療達到緩解疾病的成效。治療反應不佳與復發型的急性淋巴性白血病患者,有8-9成的機率可以完全緩解;而瀰漫性大B細胞淋巴瘤患者則有4-6成可以完全緩解。病患可以不用接受強力的化療,也可以用此免疫細胞療法控制病情。現衛福部規定僅能在九家擁有專業團隊之醫學中心才可執行。李啟誠理事長指出,在健保支持下,CAR-T細胞免疫治療日益普及,也提醒患者,若治療期間發現治療反應不佳或出現復發的跡象,切莫對治療失去信心。患者應主動與醫師討論自己的治療期望,這有助於打造個人化治療方案,並積極遵循醫師的建議治療,便有機會擊退癌症陰霾,重新掌握人生主導權。關心食安、健康的朋友們別錯過~!LINE社群搜尋:健康一把抓加入我們,立刻掌握全家大小的健康與秒懂食安地雷,還有獨家健康小撇步!!【健康一把抓】→https://reurl.cc/qrypl3

竟天APC201二期臨床收案將完成 2025年Q1初步數據結果
台股30日加權指數收盤22,820.43點,下跌106.16點,跌幅為0.46%。竟天(6917)今天表示,治療膝蓋骨關節炎新藥APC201的澳洲二期臨床試驗推進順利,2025年第一季將有初步數據結果。竟天今天以16.05元作收,下跌1.15元,跌幅為6.69%。竟天表示,治療膝蓋骨關節炎新藥APC201的澳洲二期臨床試驗推進順利目前收案超過85%,今年底前完成全部受試者收案目標不變,明年第一季將有初步數據結果,屆時將規劃進行全球多中心三期臨床試驗,並同步尋求國際授權與合作的機會。在美國被核准治療骨關節炎藥物濃度最高、效果較佳的非類固醇消炎產品(NSAID)產品為Diclofenac 2%溶液劑,也是目前美國同成份藥品濃度最高且市佔率最大的產品,年銷售額超過十億美元。但該產品因採溶液劑型、易滴落且價格昂貴,加上使用吸水性強的有機溶劑二甲基亞碸(DMSO)為溶劑,刺激性較強,由於一天需使用2次或4次,約有65%的患者在臨床試驗時感到患部更緊繃不舒適。竟天自主開發的APC201,透過雙效脂質專利配方設計,可有效提高藥物濃度至4%,將用藥次數縮減為一天1次,且無添加刺激性溶劑,不會對皮膚產生刺激,大幅提升吸收率與降低副作用。此外,APC201為泡沫劑型,用於膝蓋部位不會滴落,增加病人的使用意願及方便性,一旦能獲准上市,將可提供病患新的治療選項,並分食龐大的骨關節炎疼痛市場商機。APC201在澳洲進行一/二期臨床試驗的二期臨床收案,目前已完成85%的收案進度,預計2024年底完成二期臨床試驗,並進行數據統計與分析,2025年第一季將取得初步數據結果,公司將以此規劃全球多中心的三期臨試驗設計,並同步對外洽談國際授權與合作的機會,以獲取權利金及階段里程碑金。

國邑吸入新藥完成澳洲1期臨床 激勵股價上漲1.75%
國邑(6875)吸入新藥L608完成澳洲一期臨床結果揭曉,激勵24日股價上揚至63.9元,上漲了1.10元,漲幅達1.75%。台股本日加權指數收在23,192.52點,下跌142.24點,跌幅達0.61%。國邑總經理甘霈表示,L608是以微脂體包覆伊洛前列素的新劑型藥物,2023年底獲得美國FDA授予治療系統性硬化症的孤兒藥資格,L608的策略會先鎖定硬皮症的治療,挾孤兒藥法規優勢,在本次取得一期臨床數據後,將與美國FDA於今年完成Pre-IND會議,諮詢直接進入SSc-RP/DU二/三期臨床規劃建議,以加速L608的開發進程,盼能及早上市、造福病患。另外,本次一期臨床亦證明國邑自行開發之霧化器可達到使用方便與快速給藥之效果,未來將提供病患更方便的治療模式。國邑23日公告,吸入新藥L608完成澳洲一期臨床試驗,結果顯示在最高劑量下仍具有良好安全性與耐受性,且無嚴重不良反應。接下來除持續規劃治療第一類肺動脈高壓(PAH)二期臨床設計外,由於L608已取得美國FDA授予治療硬皮症的孤兒藥資格認定,預計將以此次的一期臨床試驗數據資料,在今年底前完成與美國FDA的Pre-IND會議,討論治療系統性硬化症相關雷諾現象和指尖潰瘍(SSc-RP/DU)之臨床試驗設計,並進行後續的IND申請。國邑指出,治療PAH吸入新藥L608的澳洲一期臨床試驗,在64位健康受試者中,使用至40 mcg的最高劑量下,配合自行開發新型網式振動霧化器給藥,所有受試者都具有良好的安全性與耐受性,且皆無藥物相關的嚴重不良反應(SAE)發生。硬皮症是一種非常罕見的自體免疫系統疾病,而雷諾現象和指端潰瘍是硬皮症患者血管方面受影響的的主要臨床特徵。SSc-RP/DU在美國並無任何治療藥物獲准上市,在歐洲則僅有一項上市的注射藥物,但需於醫院接受治療,對患者來說,存在迫切未滿足的醫療需求。

濫用瘦瘦筆!狂吐一個月食道出血 專家提醒「6種人不適合打」
許多民眾為減肥使用時下流行的「瘦瘦筆」,但瘦瘦筆是藥品!瘦瘦筆為一種「類升糖素胜肽-1(Glucagon-like peptide-1, GLP-1)」賀爾蒙藥品,稱作GLP-1受體促效劑。目前食藥署已核准的GLP-1受體促效劑藥品中有4種(liraglutide、semaglutide、dulaglutide及lixisenatid),適應症均為治療糖尿病或預防心血管事件的發生,但僅有liraglutide及semaglutide的核准的適應症可用於體重控制。南投衛生局陳南松局長表示,即便liraglutide及semaglutide經醫師處方可用於體重控制,但民眾仍應遵循醫囑,在藥品核准的適應症及用法用量下正確使用,例如成人身體質量指數(BMI)大於30、成人BMI在27至30間且有一項體重相關疾病等,並配合飲食控制體重,才能瘦得健康有元氣。台北市立聯合醫院中興院區整合醫學照護科主治醫師姜冠宇曾受訪表示,臨床上遇到一名個案,施打兩、三次後嚴重併發嘔吐連續一個月,照胃鏡發現,吐到胃疝脫,就是嘔吐到胃凸到橫膈膜的位置,導致更容易胃食道逆流,並且食道裂出血,已無法吃東西只能住院持續觀察,連續就醫都難以改善。姜冠宇說,瘦瘦針的臨床試驗顯示約有5%至9.2%的患者會發生噁心和嘔吐,數字看來無感,但真的產生副作用相當可怕。營養師高敏敏則提醒6種人不適合打瘦瘦針,分別是孕婦或哺乳媽咪、18歲以下及75歲以上者、膽囊炎患者、胰臟癌患者、個人或家族有甲狀腺 髓質癌病史、第二型多發性內分泌腫瘤症候群。陳南松呼籲民眾注意,前述藥品均為醫師處方用藥,皆須經醫療診斷後,由醫師針對適應症開立處方籤,民眾亦須留意自身病歷的處方合理性及與醫師討論使用方式及劑量等。為加強管理糖尿病治療用GLP-1 agonist注射劑藥品之流向及使用稽查專案,南投衛生局今年度共查核9家次,未發現違規情事。民眾有減重需求,應先從改善飲食習慣做起!適當的飲食形態配合適度的運動,才是減重路上的好幫手。藥物減重也應先諮詢專業合格的醫師或藥師,倘出現身體不適等情況,應先停藥並立即尋求專業醫藥人員協助。

減重防禦股2/康霈女總談創業淚灑人生 當年「淨值剩1元」押房籌錢不敢說
堪稱首檔醫美新藥股康霈(6919)10月4日以433.8元由興櫃轉上市,一開盤股價就大漲24%衝上537元,9日收盤價為522元,其大股東友華(4120)股價今年以來上漲10多元。這一檔所開發新藥雖尚未取得藥證,但投資人已在股價上反應期待,原因是康霈的新藥為局部減脂注射劑且陸續公布的臨床數據令人驚艷,搭上瘦瘦筆帶動全球減重塑身熱潮列車。康霈上市記者會後,CTWANT記者專訪董事長徐坴暉與執行長(總經理)暨研發長凌玉芳,兩人回首12年創業路,不約而同提到2019年公司走入谷底,淨值只剩一元,借錢照發薪水,在人前強顏歡笑,「我那時把房子抵押揹到二胎,跟太太財產分開制,免得受我牽累……。」徐坴暉回首這段找錢留人的辛苦歷程,看似雲淡風輕,實則幾經峰迴路轉,尤其是2021年5月間,在董事張高榮醫師推薦公司給友華生技(4120)董事長蔡正弘,8月引進資金1.68億元,翻轉康霈命運,順利催生新藥。負責新藥催生的正是凌玉芳,她主導研發同時身兼總經理、執行長,公司上百項專利都出自她的手。凌玉芳出身桃園軍人家庭,考上北一女後因參加街頭遊行,父親擔心台北自由學風讓女兒不夠專注學業,轉學到中壢高中,後來陰錯陽差考上成功大學工業設計系。但她鍾情化學,遂轉攻成大醫學院生物化學暨分子生物學研究所碩士畢業。康霈研發局部減脂注射劑,其臨床試驗專選最難減重的腹部。圖為康霈創辦人、執行長暨研發長凌玉芳。(圖/報系資料)「這是我第一次談康霈,說到流眼淚。」蓄著大波浪長髮、有著彩繪指甲、一雙炯炯有神大眼的凌玉芳,總是笑臉迎人,她接受CTWANT專訪首度談起自己的人生故事,包括姐姐癌逝及讀學時身兼五家教、一個麵包啃一天等種種生活苦境,逼使自己從低谷中站起來。畢業後,凌玉芳進入新藥相關產業,從事醫藥法規與專案管理,也做醫美行銷需求分析多年,直到2012年才決定與徐坴暉出來一起創業,走上研發醫美減脂新藥之路。凌玉芳解釋,「我完全是從醫美和市場角度來看需求,我看了許多研究報告,也訪談了許多醫師,幾千頁的外文資料也讀,發現很多人想要局部減脂但害怕動手術,苦無沒有好的非手術治療方法,因此才會想開發此類新藥,而且還要做別人沒做過的地方,就是最難減脂的腹部,開始著手。」這讓她吃盡了苦頭,因為用注射劑做腹部局部減脂,不但在台灣沒有,在全球的新藥臨床試驗也史無前例,甚至沒有主持相關類似經驗的試驗主持醫師團隊和CRO,剛開始的前二年,他們寫電郵到歐美許多臨床試驗機構邀請醫師加入,「很多人覺得康霈是言不見經傳的小公司,根本不理睬我們。」凌玉芳說。凌玉芳接著進一步說,「幸好澳洲的Dr. Goodman熱愛研究願意擔任CBL-514的2a臨床試驗的主持人,等到我們2a期臨床試驗數據療效很顯著,才陸續有知名醫師願意加入試驗,且隨著更多數據公布,現在是好多國際知名醫師主動寫信給我們想要加入CBL-514的臨床試驗。」凌玉芳談到推動新藥研發的臨床試驗過程中,從找錢、募資到邀請醫師擔任試驗主持人,人前人後她和徐坴暉看盡了臉色,但二人始終不放棄。如今,康霈的新藥CBL-514注射劑預計今年Q4與明年Q1公布2項局部減脂2b臨床解盲統計數據;此外,同成分但劑量與劑型不同之CBL-514D,專注用於疾病治療用途,目前在罕病竇根式症亦進入2b臨床階段。友華生技2021年間決定投資康霈後,成為法人注資領頭羊,讓康霈擁有資金可以推動多項新藥臨床試驗。圖為友華生技董事長蔡正弘。(圖/報系資料)CTWANT特別問了一路走來遇到哪些貴人?凌玉芳秒回恩師,成大醫學院生物化學暨分子生物學研究所賴明德教授,當初不在意她大學並非讀相關科系,也無經過實驗室實習,仍收她當研究生,開啟了她對分子生物學的熱愛和專業,也因此進入細胞凋亡的研究領域。「他給我非常大的空間,我在實驗室不只一次的修改做實驗的方法還有流程,他只要跟我溝通過覺得合理都欣然接受並且一路支持我」「我需要去家教來賺生活費和學雜費,他也容許我在用餐時間先離開去家教。」當年,只有凌玉芳一人邊唸研究所邊家教,大部分教授不容許。接著,凌玉芳提到股東Joe,「他當初評估覺得康霈有潛力,但他老闆不願意投資,結果他選擇自己投資我們」「後來也找了很多好朋友投資一路支持我們,包含在我們淨值剩1元左右的時候,也協助我們找投資人買回部分不願意繼續投資的股東股票,幫公司解決困境。」還有一位Mike,是Joe的好友,「我們上興櫃後,這位股東一路買,目前是前十大股東,他是骨科醫師,非常了解超音波導引注射,這次的阻塞型睡眠呼吸中止症(OSA)也是因為他有受此之苦,我們才發現514可能可以治療OSA,他本身對投資和生技領域都蠻熟悉的,我們的數據他也都看得懂。」「我們2023年現增30億元風雨飄搖之際,最後能夠順利成功並且超額認購,Mike和Joe幫了非常大的忙⋯…,因為他們在投資圈認識很多投資人本身又很專業,所以介紹並說服了很多投資人加入我們的現金增資,那時候我們的價格一度已經跌破現增價,很多人都傳我們現增會失敗……。」「還要感謝友華蔡董看好我們,義無反顧成為康霈第一個法人投資者,帶動其他的投資人願意投資我們,才讓康霈有相對充足現金可以推進後續的臨床試驗,成功完成興櫃前二次現增取得十幾億現金,更得以展開多個適應症的二期臨床試驗。」其實,友華本身在2022年也是有代理一款抑制食慾為機轉的減重口服新藥「康纖芙」(Contrave),正式進入減重市場;而在這之前則是投資康霈取得股權約3.1%(康霈發行新股的最新持股比率),並擁有康霈CBL-514溶脂注射劑台灣獨家代理銷售權的優先議價權,這也讓友華股價跟著起飛。如今康霈從興櫃轉到上市,二位創辦人念茲在茲的貴人,以及一路相挺的公司團隊與許多股東們,讓他們有機會完成全球第一個局部減脂新藥開發。

羅廷瑋爆食藥署「任人唯親唯綠」 邱泰源:不可能的事情
國民黨立委羅廷瑋今(9)日召開「任人唯親唯綠,汰除不適任官員」記者會,痛批食藥署人事制度崩壞,人事任用大部分都出現了問題,絕非個案,只要符合長官親人、綠營好友兩大要件,即可馬上錄取,食藥署視法律於無物,要求衛福部長邱泰源三天內給全民交代。羅廷瑋指出,前臺灣製藥工業同業公會理事長、現任江蘇達亞生技副董事長、江蘇生達生技總經理、生展生物科技股份有限公司董事長陳威仁,女兒任職於食藥署藥品組第三科,該科掌管全國學名藥的審核藥品許可證准否之業務,女兒則是負責發藥證給爸爸的人,這有沒有風紀問題?政風單位應該徹查其間是否有利益輸送及洩密的問題?她父親同時還在擔任中國大陸江蘇等生技公司要職,有內神通外鬼、瓜田李下之嫌。羅廷瑋續指,早在前食藥署姜郁美署長任內,陳威仁女兒就遭披露這樣的人事有問題,趕緊把她調離開,讓她在藥品組六科工作,跟她爸爸業務較無關,後期還轉至企科組工作,跟她爸爸業務完全無關,為何現在又來藥品組第三科?是誰決定該職員可以來藥品組三科?還是因為爸爸曾任行政院政務顧問?羅廷瑋接著提到,食藥署主秘李明鑫女兒也在藥品組擔任助理審查員,該人事案有沒有違背《公務人員任用法》第26條:三等親不得在本機關任用的規定?當初在設立甄選條件時,有沒有已經「先射箭後畫靶」?在面試時,面試委員會不會考量到李明鑫的關係而放水錄取?她畢業於輔大兒童與家庭學系,科系背景有符合「臨床試驗」業務所需?要求食藥署出來講清楚說明白。此外,現為食藥署國會聯絡人的林姓副審查員,曾任職綠委辦公室多年,經查證林姓副審查員畢業於輔大哲學系,羅廷瑋認為,其並不符合當初公告需具有「國內外食品、藥學、醫學、醫事技術、公共衛生、生物科技、法律及公共行政等相關研究所畢業,並取得碩士學位」的任用資格條件,最後卻因為綠委關心而錄取,每個月約可領4萬8,痛批用人唯親唯綠,不避親,只要是親,不管資格有沒有符合,什麼都可以,只要是綠色,什麼職務隨你挑,既然不符合資格者都可以聘用,那符合聘用資格的備取者情何以堪,既然要他們陪榜,那食藥署是不是應該支付陪榜費用?沒有資格卻聘用了,現在是否應該追討薪水?因為那是國人辛苦納稅錢。最後,羅廷瑋強調,食藥署聘用審查員的經費來源是來自於藥品許可證的審查費,是民脂民膏,而逐年提高藥品許可證的審查費,給業界的理由說是要提高審查的品質與速度,要跟世界接軌,殊不知既然是藉由提高審查費,可以多作人情、多聘一些親友團非專業的審查員來上班,這不符合提高審查費的目的。也要求衛福部長邱泰源三天內給全民交代。對此,邱泰源今天受訪否認,表示這是不可能的事,因為他上任到現在從沒管過食藥署的任何人事。並說,只有現任食藥署署長莊聲宏,是經過藥界、各個大學的藥學院所尋找推薦出來的,這部分絕對沒有外傳的人事安插。

智慧醫療新世代 衛福部成立三大AI中心
衛生福利部於今(7)日正式宣布成立「負責任AI執行中心」、「臨床AI取證驗證中心」,以及「AI影響性研究中心」。各中心將透過建立跨層級、跨體系醫院之合作,有效解決AI應用於臨床場域所面臨的「落地」、「取證」及「給付」三大關鍵議題。此將不僅為國內AI醫療應用重要里程碑,更展現臺灣政府推動智慧醫療之前瞻性政策。三大類型AI中心補助計畫於今年7月23日公告並舉辦全國性教育訓練,8月1日截止收件,各層級醫院熱烈參與,共計30家醫院提交48案,經過國內外委員三階段評選,共計16家國內醫院通過決選(19案),包含臺大、中榮、北榮、成大、中醫大、三總、林口長庚等指標醫院。衛福部說明,各國在推動智慧醫療時,面臨的挑戰包括 AI 軟體在臨床應用時可能出現的偏見、不透明性以及資安與隱私問題。此外,AI 產品在取得食品藥物管理署(TFDA)認證過程中,需要廣泛的數據來進行驗證,驗證數據取得困難。最後,一些關鍵應用如何透過科學方法來評估其健保給付,並驗證臨床效果,這些都是智慧醫療推動時所面臨的主要挑戰。因此,衛福部指出,先進國家開始推出一些法案架構和共識指南,作為監管的指引方向,例如世界衛生組織(WHO)之負責任AI六大原則,歐盟之AI法案,以及美國AI運算法透明及資訊共享規則(HTI-1)等。然而,這些政策宣示尚未在各國具體落實成為推動中心。為前瞻布局,衛生福利部輔導臺灣醫院成立三大類型AI中心,作為解決推動智慧醫療最後一哩路。以下分別對三大類型AI中心進行介紹:第一類「負責任AI執行中心」透過制定符合資安與隱私保護的管理辦法,公開AI模型、資料和效能等重要資訊,提供可解釋性分析結果,提升AI透明度,同時建立AI模型生命周期管理辦法,以確保AI在臨床使用具有持續可靠性。第二類「臨床AI取證驗證中心」為衛生福利部資訊處和TFDA合作,旨在解決國內醫療AI軟體取證過程冗長及蒐集具臺灣人群代表性驗證資料集的困難,以往AI外部驗證機制缺乏跨層級醫院協作、系統性常設機構和專責人員,該類中心將預先組成醫院聯盟,常設機構和專責人員串接跨體系及跨層級之電子病歷資料,藉以協助廠商驗證AI模型,提升驗證速度以及在臺灣人群的準確性,促進產品商業化進程,幫助國內民眾更快速享受到高品質的智慧醫療產品。第三類「AI影響性研究中心」為衛生福利部資訊處和中央健康保險署合作,旨在解決國內AI醫療應用爭取納入健保給付的挑戰,由於AI產品的價格無法依循傳統醫療器材從製造端進行成本評估,中心將建立跨體系、跨層級的臨床試驗機制,並由多專業團隊設計研究,進行AI臨床效益評估,確保AI產品兼具臨床有效性與健康效益,同時建立科學性的定價基礎。衛福部也與健保署合作,透過AI影響性研究中心協助國內AI醫療應用爭取納入健保給付,由於AI沒有耗材,難以比照傳統醫療器材從製造端進行成本評估,中心將建立臨床試驗機制,進行AI臨床效益評估,確保在臨床的有效性與健康效益,再交由專家評估是否納入健保。三大AI中心召集人、臺大醫院院長吳明賢表示,全世界百工百業都在使用AI,唯獨醫療產業進展最滿,由於醫療牽涉到健康、生命、法律問題,要在確保服務品質安全的前提下處理。吳明賢認為,台灣醫院數位資料庫完整,已具良好大數據基礎,也有法規協助推動,三大AI中心的成立,證明台灣能在醫療產業領航全球。

國邑新藥L606與美Liquidia增修合約 總座:授權金達3.9億美元
國邑*(6875)最新公告,與美Liquidia Technologies, Inc.完成增訂L606之授權合約,新增授權國家,並另與其簽訂霧化器專屬授權合約,授予國邑自主研發霧化器配合L606組合產品新藥的研發及商業化權利;可收取簽約金350萬美元,後續則依里程碑達成情形將收取1億5,775萬美元產品開發里程金及銷售里程金,本次增修合約授權金達1億6,125萬美元,約新台幣51億元。國邑1日收盤價64.7元,下跌0.30元,跌幅達0.46%。國邑總經理甘霈表示,2023年6月將旗下用於治療第一類肺動脈高壓(PAH)及第三類間質性肺病相關肺高壓(PH-ILD)吸入性新藥L606,以2億2,500萬美元授權予Liquidia公司後,很高興能再次促成雙方有更緊密的合作關係,依原合約及此次增修合約,L606新藥的總授權金額高達3億8,625萬美元(約新台幣123億元)。本次不僅擴增授權地區,更納入國邑自有品牌新一代網式振動霧化器做為給藥器械,以全套「藥物+器械」組合強化了產品競爭優勢,也象徵雙方合作進入新程里碑。國邑藥品科技2日發布重訊,與北美夥伴Liquidia完成簽署增修L606新藥授權合約,拓展授權區域至北美以外的全球市場(排除台灣、韓國、東南亞、中國、中東、北非、土耳其等國家與地區)。雙方並且新簽訂一項霧化器專屬授權合約,Liquidia將取得國邑自主研發霧化器配合L606組合產品新藥的開發及在授權區域商業化權利。根據本次增修與新簽署合約,未來國邑將依雙方合意價格,供應L606藥物及專用霧化器組合產品予Liquidia。Liquidia負責於授權地區進行臨床試驗、藥證申請及產品上市後的行銷推廣,並且支付相關費用。在藥械組合新藥L606正式上市銷售後,國邑可依銷售淨額級距另抽取低雙位數百分比的銷售權利金。國邑表示,透過本次增修的授權合約,Liquidia等於一舉拿下全球肺高壓藥物的二大重點市場—美國與歐洲的入場券,尤其是歐洲市場迄今尚無獲准治療PH-ILD的相關藥物,L606挾長效劑型、低副作用及使用方便之優勢,有機會成為第一個獲准上市的產品。