王德原
」 食藥署 藥品 衛福部 輸液 回收
生達製藥6項藥品異常!食藥署要求年底前完成下架回收
衛生福利部食品藥物管理署9月進行藥品抽查,昨(18)日公布「生達化學製藥股份有限公司」有部分產品生產品質異常,要求廠商進一步釐清,並陸續在今年底前完成回收,需繳交回收成果報告書,及後續預防矯正措施。食藥署公布「生達化學製藥股份有限公司」6項藥品異常,包含皮膚科用藥「施賓娜親水性軟膏」和「百吉乳膏」、帕金森氏症用藥「恩克帕膜衣錠200毫克」、精神科用藥「速立安錠(樂耐平)」、腸胃科用藥「暢腹立膜衣錠212.5/5毫克」、解熱鎮痛用藥「舒抑痛口服懸液20毫克/毫升(異布洛芬)」。食藥署副署長王德原表示,今年9月25日至27日至藥廠執行例行性GMP查核時,抽查發現部分產品生產品質異常,且相關調查並不完整,要求廠商需進一步釐清原因,當場已責令藥廠盡速啟動完整調查。王德原表示調查後發現有6項藥品異常,6項藥品的市占率約2.9%到23.8%不等,且均有至少2張以上同成分同含量同劑型等藥品許可證。目前已要求廠商啟動下架回收不合格產品,並在年底前完成作業,食藥署後續將追蹤藥品回收情形,並確認藥廠落實改善,以保障民眾用藥安全。

神經炎用藥發霉了!急回收「福元健力命糖衣錠」2批號、58.4萬錠
衛福部食藥署日前公布,用於治療神經炎、腳氣病、維他命B1缺乏症的「福元健力命糖衣錠」,經醫療機構通報藥品發霉、外觀異常,將先行啟動2批號共58萬4000錠回收作業,分別為GLM404及GLM405,並將於明年1月3日前完成。根據食藥署發布的藥品回收訊息,福元化學製藥股份有限公司的「福元健力命糖衣錠 Genlimin S.C. Tablets “F.Y.”」,批號GLM404及GLM405的產品,因接獲藥品不良品通報,將啟動回收作業。食藥署副署長王德原表示,食藥署於11月28日接獲醫療機構通報,指出打開批號GLM404的藥品瓶後,發現有1顆藥品發霉,於是以電郵及函文方式,請求廠商全面清查該批號藥品於醫療機構、藥局及庫存,確認是否有類似情況發生。王德原說,業者於12月2日回覆,不良品發生原因仍在調查中,由於GLM404及GLM405為連續生產批號,為防範風險,將先行預防性回收兩批號藥品。食藥署已要求廠商應在明年1月3日前完成回收作業,並規定廠商要於12月28日前提交清查結果、調查報告、預防矯正措施及預計改善時程等相關資料。王德原指出,目前尚未接獲案內批號或其他批號藥品有類似不良品的通報案件,初步評估為單一案件,以往也未曾接獲該藥品有類似不良品情形的通報。食藥署提醒,如果民眾對使用的藥品有任何疑慮,應盡速回診與醫師討論,也請各醫療院所、藥商、藥局配合辦理回收作業,立即停止調劑、供應。
國光流感疫苗出包「藥劑變淡黃色」 專家分析:可能有2原因
公費流感疫苗自本月1日起開打,但疾病管制署(12)日晚間宣布,接獲基隆市通知發現1劑國光流感疫苗「外觀變色」,同批號庫存已配送至6縣市,總計10.8萬劑暫停使用,並通報食藥署啟動機制調查釐清。據專家分析,該疫苗藥劑呈現淡黃色應,可能是「氧化」導致,原因可能包含冷鏈溫度不足,或是疫苗密封出現異常,應盡速找出原因,才能避免類似事件再次發生。衛生福利部疾病管制署傍晚發布新聞稿指出,接獲基隆市衛生局通知,七堵區衛生所通報在12日流感疫苗接種前,主動發現1劑目測外觀變色的國光流感疫苗,當即保存該變色疫苗並依程序通報、並未提供接種。據《ETtoday新聞雲》報導,感染科權威、中國醫藥大學附設醫院感染管制中心副院長黃高彬受訪時表示,國光流感疫苗出現外觀變成淡黃色,推測最可能原因是氧化現象,而導致氧化有2種可能,一是溫度保存不足,二是疫苗密封異常。黃高彬表示,國光流感疫苗屬於雞蛋培養疫苗,保存溫度應在攝氏4度以下,原則上,疫苗即便保存在攝氏4到8度之間,1、2小時都不至於讓疫苗變色,可能要超過6小時才會出現異常,可能涉及問題包含運送或者存放。不過冷鏈問題通常僅影響到疫苗效力,至於疫苗容器密封性的問題,就可能要評估成分變質等影響。黃高彬也強調,民眾不用因此感到恐慌,問題疫苗並沒有被使用,其他疫苗沒有變色則不用擔心,但是藥廠還是要盡速釐清,避免問題再次發生。疾管署副署長羅一鈞表示,七堵區衛生所通報後,清查該衛生所內同批號(FSZA2408)疫苗其他70多劑,並未發現其他疫苗有類似情形。據羅一鈞說明,該批號疫苗共計驗收約18.3萬劑,已配送至6縣市衛生局,包括:台北市、基隆市、桃園市、苗栗縣、花蓮縣及台東縣,估計已經使用7.5萬劑,庫存約10.8萬劑則已緊急通知停止使用。同時衛福部食藥署已要求廠商依藥品不良品通報機制儘速調查釐清,以判斷是單一個案或系統性問題。食藥署副署長王德原表示,會請國光公司就不良品發生原因進行調查,釐清是單一事件或系統性事件,並且提出改善措施,就算只有這一劑,也要釐清為什麼會發生這劑異常。疾管署表示,將依全面清查結果,預定於10月14日下午邀集專家、衛生福利部食品藥物管理署、基隆市衛生局及疫苗廠商召開會議,探討疫苗品質及接種安全。
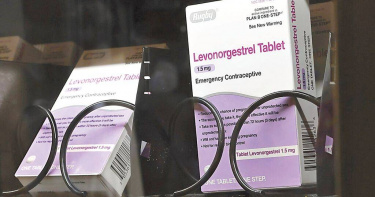
事後丸擬改為指示藥…引發各界激辯 食藥署:短期內仍無法取得共識
本報獨家報導,衛福部食藥署今年8月開會討論將「事後避孕藥Levonorgestrel」由處方藥改為指示藥,讓民眾可在藥局購買,引發各界激辯。早在2016年,食藥署就準備將該藥轉類,並祭出6大限制,包括僅限17歲以上使用、不得開架陳列、不可申請廣告等,但當時社會爭議甚大,擱置至今長達8年。如今重啟討論,再度面對爭議,食藥署仍只回覆,短期內還是無法取得共識。Levonorgestrel(左炔諾孕酮)是第一代事後避孕藥,針對無事前避孕者,由醫師開立處方箋,在性行為後72小時內服用。食藥署2016年12月曾發布新聞稿表示,廠商申請緊急事後避孕藥轉類案件,經食藥署指示藥品及成藥諮議小組審核完畢,食藥署正進行文件審核相關行政作業中。食藥署當時說明,緊急事後避孕藥轉類為指示藥品後,將規定廠商執行6項措施,包括:限制使用年齡為17歲以上、不得開架陳列、以單次所需量包裝、不可申請廣告以避免濫用,並且加強查核、監測此類藥品使用情形,以及廠商需提供藥師相關教材及教育訓練。但多年來,食藥署遲遲未公告該藥轉為指示藥品,直到今年8月重啟討論。食藥署副署長王德原說明,雖然當時諮議會的立場認為可以轉類,但畢竟社會爭議甚大,還沒形成共識,因此暫緩。王德原表示,近期因有立委關切,因此再度找專家團體來徵詢意見,主要是醫界專家,會議上充分表達各自立場。他坦言,狀況和2016年時一樣,看來短期內仍無法取得共識,將持續蒐集意見,目前尚無規畫後續時程。至於6項配套措施,由於尚未轉類成功,因此並未實施,目前Levonorgestrel仍是處方藥,需由醫師開立,並根據藥品仿單說明使用。十大先進醫藥國家中,已有8國將Levonorgestrel改為指示用藥管理,包括美國、英國、瑞士、加拿大、法國、比利時、瑞典、澳洲,而德國和日本仍屬處方藥。王德原強調,不同國家民情不同,仍需要建立社會共識。生殖醫學會常務理事張甫軒表示,藥師和醫師的角度絕對是不一樣的,但台灣醫師都是站在全民的福利做事情。用藥並非百分之百安全,最好還是由醫師把關,萬一用藥後子宮外孕,或是懷孕甚至流產,可能有生命危險,台灣醫療這麼進步,開業醫師也很多,找醫師做專業判斷和追蹤,可避免「非必要之惡」。藥師吳厚澤表示,並非避孕藥造成子宮外孕風險,而是使用事後避孕藥後,未再用驗孕棒確認懷孕。若轉換成指示藥品,可以讓民眾第一時間服用,增加避孕成功率,後續如果有其他疑慮可另外安排就診,就如同服用感冒藥緩解症狀後之後,若有其他疑慮,還是可以就醫。每個藥物都有其副作用,即使是指示藥品,在每位藥師都完整做完指示藥品的衛教,才能真正為藥物把關。

食藥署要查乳酸飲料抗藥性 衛福部打臉:不太可能
行政院會26日核定投入19億,建立國家級防治平台,減緩相關危害,但近期食藥署宣布將針對如養樂多、優格、優酪乳等乳酸菌產品,定期抽驗相關菌種的抗藥性,引發關注。不過,衛福部昨指出,乳酸菌不太可能造成抗藥性。衛福部與農業部共同執行「國家級防疫一體抗生素抗藥性管理行動計畫」,目標5年內減少5%的抗生素用量,其中「食媒微生物抗藥特性研析」是調查分析市售即食食品中沙門氏桿菌等特定食媒病原,以及市售乳酸菌產品中腸球菌等潛在抗藥菌種的抗藥特性,評估潛在食安危害及消費風險。衛福部疾管署副署長羅一鈞簡報指出,抗生素抗藥性是全球10大健康威脅,與全球每年約500萬人的死亡有關,持續惡化將造成全球至2035的平均壽命將縮短1.8年,至2050年經濟損失可達GDP的2%至3.5%。以2%計算,台灣損失將超過3000億元。針對食藥署要查乳酸飲料抗藥性,衛福部次長周志浩解釋,食藥署主要針對食品當中有哪些致病菌,以及是否有抗藥性,再跟人體做對照比較,這屬經常性計畫,都會抽檢並比對,人體端也經常會做監測。食藥署副署長王德原說明,「食媒微生物抗藥特性研析」屬於調查分析研究,並非作為食品稽查的標準,目的是建立背景值,具體做法是透過例行稽查專案取得檢體,如果成功培養出細菌,再送到國家實驗室分析是否具有抗藥性。過去曾在2種腸球菌發現有抗藥性,因此食藥署2019年公告限制不得作為食品原料。王德原進一步說明,希望藉由這次計畫,了解其他菌種是否有抗藥性,因此針對即食產品(如生魚片、三明治等)及乳酸菌產品(如優酪乳、益生菌膠囊等),配合原有的稽查專案去分析,如有發現抗藥性情形,將提供給該計畫主政機關疾管署。不過,周志浩強調,一般而言,乳酸菌不太可能會造成抗藥性,因為其他細菌要在這裡面生長其實並不容易,他個人還沒有看到乳酸菌有產生抗藥性的現象,但衛福部會持續做好把關工作。

改每年更新!必要藥品清單擴大至597項 輸液也入列
台灣屢屢缺藥,食藥署20日預告修正「必要藥品清單」,將每2年修訂一次必要藥品清單,改為1年檢討公告一次,這次更擴大至597項,比上一波名單增120項,除了癌症、抗感染、心血管藥品占最多外,近期因為永豐新莊廠停產而導致大缺貨的輸液,也被列入。此外,若臨床需求高,市占率超過6成就將評估列為必要藥品清單。藥界則建議訂出緊急應變模式,避免再發生如缺輸液卻只能高價進口。現行《藥事法》第27之2條所列的必要藥品清單,共計481個品項,本次預告擬修正為597項。新增最多的前三類別是「抗腫瘤及免疫調節劑」共27項、「抗感染藥品」共19項,以及「心血管藥品」共18項,例如治療中度至重度異位性皮膚炎的標靶藥物abrocitinib、兒童鎮痛退燒藥acetaminophen、高血壓用藥valsartan和心肌梗塞用藥ramipril。食藥署副署長王德原說明,我國必要藥品清單過去主要是配合世界衛生組織(WHO)必要藥品清單更新頻率,每2年修訂一次,但考量國內藥品供應狀況變動較大,為了更符合國內臨床使用情形,未來將改為每年檢討更新。另外,本次也針對近期供應不穩或較可能短缺的臨床重要品項,當製造廠市占率大於60%、或製造廠3家以下,且臨床需求很高時,就予以納入必要藥品。例如前陣子因永豐新莊廠停產,造成全台大缺貨的沖洗用、注射用生理食鹽水和蒸餾水,就被納入必要藥品清單。藥師公會全國聯合會理事長黃金舜表示,全球先進國家都有規畫必要藥品清單,大約有500多項,各國訂定標準不一,台灣過去只有100多種,近年因為藥界不斷倡議之下,看到政府有誠意改善,如今已增加到597項。台北市藥師公會顧問張文靜認為,食藥署新增120項必要藥品清單,並調整為每年檢討更新,顯示政府積極監控及改善缺藥問題,樂見這樣的改變,也期望能帶來效果。但她指出,輸液需要常態穩定供應,不能因為永豐停產就一直用專案進口,希望食藥署能訂定更明確的緊急應變模式,提供業界可依循的準則。

網購藥品危險又易觸法 最重10年徒刑、1億罰金
網路購物生活所需用品已成為忙碌現代人的日常,但要注意不是所有生活必需品均可自網路購物取得。食藥署副署長王德原指出,藥品不是一般商品,目前僅開放藥商和藥局、百貨店、雜貨店及餐旅服務商得於網路販售乙類成藥如綠油精、萬金油、曼秀雷敦,其餘藥品均不得於網路、電話、廣播及電視等消費者未能實際檢視商品而買賣之實體店面通路販售。消費者不僅可能買到假藥,還可能因此被視為是以個人名義進口藥品,而涉「藥事法」遭法律制裁。南投衛生局陳南松局長表示,合法來源的藥品,如發生藥物不良反應,民眾可向衛生福利部提出藥害救濟申請、或向依據消費者保護法向各地方消費爭議委員會提出申訴。現在許多網路平台為境外網站,來源查證不易,無法取得賣家登記資訊,民眾如從網路訂購藥品,吃下肚後,萬一發生過敏不適、休克等副作用,無法申請藥害救濟及向賣家提出求償,風險均自行承擔,後果得不償失。食藥署表示,已與海關聯手加強抽查進口快遞郵包,並主動監控網路上非法賣藥行為,提醒無論消費者是自用還是轉售,一律依法處理,輸入未經核准的藥品最高可處10年以下有期徒刑,並得併科1億元以下罰金。陳南松提醒,切勿在網路買賣藥品,把握「生病看醫師,用藥問藥師」有疾病問題應尋求專業醫師診療,有藥品問題應洽藥師諮詢,並向合格藥局或藥商購買合法藥品,辨明國內核准且合法製造的藥品,其包裝上會有「藥品許可證字號」,安全有保障,若發現藥品字體模糊、仿單內容不清或印有簡體字時都應提高警覺,民眾如藥品相關疑問可自行上衛生福利部食品藥物管理署網站查詢藥品許可證。

降膽固醇40年老藥缺貨長達1年 食藥署解釋原因
膽固醇過高是國人常見慢性病,規律用藥是控制關鍵,但有民眾憂心表示,過去每天規律服用Cholestyramine(可利舒散),因國內藥廠停產,無法有效控制病況,進而感到焦急、無奈。食藥署說明,該藥物因許可證移轉導致供應短缺,預計今年10月可供應。一名憂心的家屬表示,先生有心臟血管狹窄,醫生建議將低密度膽固醇(LDL)降低至70以下,但他使用各種藥物均導致肝臟發炎,多番嘗試才找到可利舒散,每天必須服用4包才能達到治療效果,但自從國內藥廠停產後,無法再有效控制膽固醇。該名家屬說,此藥沒有國外進口,國內也沒有任何其他可使用的學名藥,由於是處方藥,也不容易從國外購買郵寄到國內,不知如何是好,擔心先生因血管堵塞導致心肌梗塞或中風。中華民國血脂及動脈硬化學會理事、新光醫院心臟醫學中心研發長常敏之表示,可利舒散是一款約40年的老藥,過去是治療膽固醇血症的重要用藥,但近年已有不少新藥問世,目前退居第三線用藥,可能因為國內市場較小,藥價又不貴,藥廠不想做了而轉手。根據他的臨床經驗,患者如第一、二線用藥效果不佳,可能會改用針劑藥物,極少患者會考慮使用可利舒散。食藥署副署長王德原表示,可利舒散是《藥事法》公告的必要藥品,若廠商無法製造、輸入或供應量不足,須在至少6個月前向食藥署通報。世達藥品去年10月申請藥品許可證移轉,後續採控貨供應,已依規定通報。王德原指出,許可證移轉並非罕見情況,如原藥廠無意繼續生產,而新藥廠願意接手,雙方即可提出申請。可利舒散的許可證完成移轉後,成大藥品需要時間準備產線等,預計今年10月可供應。

永豐2L沖洗用蒸餾水恢復生產!輸液還沒過關 食藥署持續專案輸入
永豐化學工業股份有限公司新莊工廠(下稱永豐公司)前經食藥署判定嚴重違反GMP在案,其後該廠持續進行全廠性改善作業,經歷多次檢附改善資料,經食藥署實地複查確認廠內生產之「永豐滅菌沖洗用蒸餾水(衛署藥製字第036456號)」,相關缺失已改善,爰核准前揭產品2000mL以上軟袋之製造及運銷作業,以緩解臨床用藥需求,並將於完成廠內放行程序後,優先供應予合約客戶。據了解,雖然蒸餾水可恢復生產,但「輸液」還沒辦法恢復。食藥署表示,有關永豐公司其餘產品之恢復製造情形,仍需視其實際改善情形,並經實地複查確認後依品項核定。食藥署副署長王德原透露,由於先前缺失較多,後續經實地複查,仍有一些小缺失,還在持續請業者改善,可能10月還沒辦法恢復產能。因應永豐公司新莊工廠未能符合PIC/S GMP規範而停止生產,影響大型輸注液藥品供應,食藥署自5月初起即積極採取各項因應作為。為滿足臨床需求,經請國內合格廠商持續增產,並核准專案輸入,累積至本週,專案輸入生理食鹽水,以500mL計,抵台數量將達約587.59萬瓶/袋(以500mL計,本週88.72萬瓶/袋,分別為500mL25.92萬瓶/袋、1L 31.4萬瓶/袋),食藥署並經調查臨床需求,至9月2日中午,已陸續分配予醫療機構共642家,合計約644.03萬瓶/袋(國產+專案輸入)。食藥署目前已將替代藥品資訊公布於「西藥供應資訊平台」,並建立媒合機制,醫療機構無法購得藥品時,可至該平台通報,亦會安排專人聯繫通報機構,並媒合廠商供應,至113年9月2日,計381間醫院及診所通報,共媒合1,318件。食藥署持續以國際PIC/S GMP標準,嚴謹把關永豐公司改善作業落實GMP要求,透過加強GMP管理措施,持續督促永豐公司健全製藥品質系統,確保生產產品之品質及安全;同時持續協助其他合格廠商穩定生產,維持我國輸液藥品之供需穩定性。

別亂上網買藥!食藥署抓違規網站 從這買「EVE、大正」恐被關7年
台灣人愛買日本藥妝,但要小心若從不明網站購買,可是有違法疑慮。食藥署今(29)日公告,國外網站「KUWA免稅店」涉嫌違規廣告產品,包含「大正綜合感冒藥」、「EVE藍色QUICK頭痛藥」、「日本皇漢堂強效退燒藥」等產品,若民眾從國外網站進口來台被查到,最高可處7年有期徒刑,併科5000萬元以下罰金。食藥署今公布國外網站「KUWA免稅店」販售國人愛用的多款日藥,涉嫌違規。食藥署副署長王德原說明,涉嫌違規態樣為案內產品外包裝無中文標示及許可證字號,品質、安全及療效未經確認,非屬我國核准之藥品。民眾若販售未經核准製造或輸入藥品,涉及違反藥事法第83條有關偽禁藥規定,明知為偽藥或禁藥,而販賣、供應、調劑、運送、寄藏、牙保、轉讓或意圖販賣而陳列者,最高可處7年以下有期徒刑,併科5000萬元以下罰金,請國人切勿觸法。王德原表示,這個網站IP位置在日本,因此無法處理,目前也無法封鎖其網路位置。此外,王德原也提醒民眾,有些人習慣在Amazon網站購買美國一般成藥,但許多藥品在國內屬於處方藥,若被查到,同樣也是涉及違反《藥事法》第83條。

新冠疫情升溫快篩要有 食藥署曝國內4合格品牌
新冠疫情升溫,藥局裡口罩、酒精、退燒藥等防疫物資銷量都增加,家用快篩試劑也再度成為熱門商品。食藥署表示,目前國內已核准4件新冠家用快篩試劑許可證,包括「飛確RV2」、「研準」、「台塑生醫」和「亞培」,製造及輸入產能無虞,可供應國內疫情所需。國內進入第六波Omicron新冠疫情,上周新增932例中重症個案,較前一周上升,疾管署預估7月中旬後進入高原期。目前全球主要流行變異株包括JN.1、KP.2及KP.3,現有快篩與PCR等檢測方法仍能有效偵測。近期社區藥局出現防疫物資銷量增加的情形,家用快篩試劑也包含在內,有藥師擔心可能出現缺貨。對此,食藥署副署長王德原說明,2023年1月8日公告訂定「新型冠狀病毒抗原檢驗試劑技術基準」以來,截至今年6月27日止,已核准4件家用新冠病毒抗原檢驗試劑醫療器材許可證,產能無虞,以供應國內疫情所需。王德原說明,訂定標準後是供業者作為產品上市審查準備的參考,食藥署亦主動提供相關業者諮詢輔導,優先加速審理。目前核准的4件產品分別是寶齡富錦生技製造的「飛確RV2」、「研準」家用快篩試劑,台塑生醫科技製造的「台塑生醫」家用快篩試劑,以及亞培快速診斷設備進口的「亞培」家用快篩試劑。另外,胸腔科醫師蘇一峰日前公開示警,兒童最常使用的口服抗生素Curam糖漿持續缺貨,本來有3家廠商,其中台廠永豐不做了,另外2家國外廠商Sandoz和GSK也限貨提供藥品,全台已經有多家醫院開不出藥。對此食藥署回應,Amoxicillin複方口服兒童製劑除荷商葛蘭素史克藥廠股份有限公司(GSK)台灣分公司、台灣山德士藥業股份有限公司(Sandoz)尚有輸入供應外,國內亦有永信藥品工業股份有限公司生產供應,可供臨床替代使用,過去健保月用量約2.4萬劑,目前國內庫存約10萬劑,且持續生產輸入,供應量能充足。
解決國內輸液荒代價大! 衛福部砸3億專案進口、本土增產
市占七成的永豐化工公司停產衝擊國內輸液供應,健保署7日召開共同擬定會議,決定多砸5000萬,給國內廠商高於原價的專案價,以鼓勵增加產量供應,以用量最大的500C.C.注射液為例,原價為25元,在6~10月專案期間,提高至30~35元,待專案結束,價格就會恢復常態。另食藥署也啟動7家藥商的專案進口,首批10萬瓶/袋(500C.C.)下周將到貨,包含國內增產、國外進口的產品在內共花3億元,可確保6~7月的供應無虞。健保署長石崇良表示,因應永豐停產,6~10月內,國內的藥商預估要增加500萬袋輸液的供應。輸液共有500、1000、1500C.C.3種規格,又分為注射液、沖洗液,前者3種規格都有,後者則只有500、1000C.C.。目前共有5家廠商,合計起來有5大類、13個品項。以用量最大宗的500C.C.注射液為例,過去的核價是25元,6~10月專案期間,價格則提高30~35元,石崇良預估,專案期間健保署將多支出5000萬元,用於協助國內增產,另在專案進口上,則會支出2.5億,整體花費會控制在3億元之內。石崇良表示,專案價是為了補貼廠商加班增產的成本,健保署提出3項要求,藥商必須配合食藥署調度、不得有藥價差、根據食藥署評估決定專案中止時間。專案期間為6~10月,但要在什麼時候終止還不一定,另因藥商反映,輸液價格比運動飲料低,健保署8月將召開共擬會議,重新討論輸液常態性的核價。至於輸液專案進口部分,食藥署副署長王德原表示,針對大包裝輸液,現已核准7家藥商專案進口,包括台灣大塚製藥、韋淳、台灣柏朗、培力藥品、美達特、橫山、百特,下周起陸續輸入,首批至少有10萬瓶/袋500C.C.的輸液,目前已上船,尚無法預估是哪一天到貨,但可確保6~7月的供應無虞。
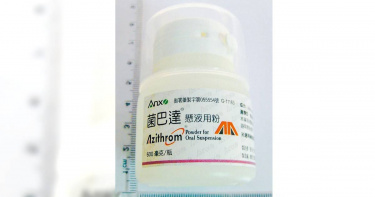
一次2款抗生素出包!市占5成「菌巴達懸液用粉」驚見結塊 食藥署下架回收
抗生素藥品接連出包!衛福部食藥署6日公布2款藥品回收資訊,其中「菌巴達懸液用粉」因民眾反映有結塊情形,共計下架回收4590瓶,該藥品市占率逾5成,但廠商尚有庫存,食藥署評估沒有缺藥疑慮。另「意欣可利制菌凍晶注射劑」則是因為實驗數據完整性不足,遭食藥署要求回收2020瓶,另有2批庫存須銷毀。「菌巴達懸液用粉」主要用於革蘭氏陽性、陰性及厭氧菌引起包括支氣管炎及肺炎的下呼吸道感染、皮膚及軟組織感染、中耳炎、上呼吸道感染及性傳染病。有民眾向地方衛生局反映該藥品潮解結塊,食藥署檢驗確定未符合原核准規格,因此要求啟動回收作業。食藥署副署長王德原表示,經調查僅有1批號產品出現問題,批號221123已銷售4590瓶,已要求廠商應於6月13日前完成回收作業,並應繳交回收成果報告書。該藥品去年健保用量共5萬2160瓶,市占率53%,由於廠商仍有庫存可供應,預估無缺藥疑慮。「意欣可利制菌凍晶注射劑」適用於一般抗生素無效、具多重抗藥性的革蘭氏陰性菌嚴重感染。王德原說明,該製造廠前次嚴重違反GMP規範,食藥署前往複查,雖已改正缺失,但又發現該藥品的效價試驗數據不完整,電腦登載不清楚,紙本記錄未妥善保存,難以證明數據真實度。王德原說,其共有3批號藥品數據不完整,其中2批仍在庫存須銷毀,另有1批已出貨,批號900060AA001共2020瓶,回收期限為6月24日。該藥品去年健保申報量僅17支,市占率低,且有9張同成分、同劑型、同含量的「三同藥品」許可證,因此不影響藥品供應。

國內輸液供貨吃緊 食藥署估情況恐持續至10月
永豐化學因實驗室數據涉及假造等多項缺失,遭食藥署判定嚴重違反GMP規範,本月10日起暫停生產。永豐生產的20項藥品中,以「大包裝注射用生理食鹽水」供應最吃緊,食藥署正協調其他合格廠商協助增產,但藥師質疑,恐難以補足每月200萬袋缺口。食藥署預估,目前永豐的庫存量可撐到6月中旬,接下來需仰賴專案進口,預估供應困難的情況會持續到10月。食藥署今年到永豐化學查廠時,發現多項缺失,判定嚴重違反GMP規範,自10日起暫停生產,造成生理食鹽水、葡萄糖等輸液供貨吃緊,儘管食藥署強調,正積極協調廠商協助增產,並徵求專案進口,但基層藥師協會理事長沈采穎質疑,以「大包裝注射用生理食鹽水」為例,目前大塚、濟生、信東、南光、台裕、中化等持有許可證的廠商,即便全部上線生產,仍可能無法彌補因永豐化學停產所造成的每個月200萬袋缺口。食藥署副署長王德原說,永豐每月生產196萬袋的大包裝注射用生理食鹽水(以500cc為單位),目前還有庫存,預計可使用到6月中旬。他預估,6、7月需求量分別為110萬袋和150萬袋,目前已有藥廠願意協助增產,之後則需仰賴專案進口,直到國內業者願意投資、常態增加產線,或是直到永豐完成缺失修正為止,預估會持續到10月左右。王德原坦言,目前確實供應吃緊、不是很充裕,但會盡量滿足需求。目前永豐的庫存藥品正由食藥署進行檢驗,只要品質無虞就會出貨給合約醫院。不過,社區醫院協會理事長、中山醫院院長朱益宏認為,若食藥署放行這一批庫存藥品,不應該只供貨給合約醫院,建議可平均分配給各醫療院所,因為通常地區醫院和廠商沒有合約,且叫貨量少,在供應吃緊的時刻,更不容易取得穩定的貨源。朱益宏說,中山醫院尚有1周庫存,雖已連繫上其他廠商,但有別於永豐的軟袋大包裝,新廠商是塑膠瓶小包裝,只能將就著用。有地區醫院向他反映,已尋求食藥署協助,但還沒找到可供應的廠商,「庫存非常吃緊,大家都擔心斷貨!」瑞東診所院長杜柏村也表示,大包裝注射用生理食鹽水對於洗腎患者很重要,不能斷貨,雖然自家不是使用永豐的產品,但仍接到廠商通知最近供貨較吃緊,希望能盡快解決。

免費惹議1/免費快篩才剛發就快到期 藥師民眾批為德不卒
衛福部五月初透過全國藥師公會聯合會轉介、在全台4500家健保特約藥局,發放「免費新冠快篩」,但決策過程卻惹議。當時,將卸任的衛福部長薛瑞元曾宣稱「免費效期大都到年底」,但基層藥局收到的卻是五月底、六月初就到期的「即期品」,讓苦等免費好康的民眾不滿,懷疑「部長說到年底前都有效的快篩被藏起來」,藥局哭笑不得之餘。薛瑞元宣傳免費快篩時,還曾提及「秋冬季節疫情可能再起」,藥局因此也提醒政府,既然要防範疫情捲土重來,就應立即發放「效期到年底的庫存快篩」,別再等蹉跎等到淪即期品才急發給民眾,讓美意大打折。基層藥師協會理事長沈采穎指出,民眾頻問何時才能領到效期較長的免費快篩,既然衛福部已決定免費發放庫存快篩,應立即處理,別讓民眾下一波領到的又是幾週內就要用完的即期品,這些都是納稅人公帑所買,應恆念物力維艱。秉持類似主張的藥局、民眾很多,衛福部疾管署只好公開說明,衛福部當時(5月初)庫存快篩約1000萬劑,其中844萬劑,分別在五月底、六月初到期,陸續發放到藥局。至於外界關切、年底才會到期的庫存快篩,僅有150萬劑、不到庫存的兩成,外界才瞭解,薛瑞元第一時間所指「大部份免費快篩效期到年底」,與事實有落差。新冠疫情最嚴重期間,民眾大排長龍一劑難求,引發大量民怨,但如今「珍貴」快篩卻淪即期品,令人唏噓。(圖/侯世駿攝)但150萬劑庫存快篩為何不一起立即發放?疾管署似有難言之隱,僅說「仍在討論中」,也讓基層藥局及民眾不解,網友更酸「難道還想等淪即期品、才讓民眾幫忙丟棄」?好不容易能領免費快篩、且有別於疫情期間排長龍未必搶得到,如今免費快篩甚至能「想拿多少就拿多少」,但藥局卻提醒都是「即期品」,多數三週內沒用完就得丟掉,民眾直呼可惜,不解衛福部既然要發、幹嘛不早發?過期能否繼續用?有國內重量級小兒科醫師、教學檢驗科主任受訪時,公開挺衛福部,指該批即期免費快篩「過期也能用」,還強調過期半年內應仍有一定精準度,但衛福部食藥署卻低調的回應「尊重專家說法」,但希望民眾能依產品說明書「在期限內使用」。換言之,並未認同「過期有效」之說。衛福部食藥署副署長王德原解釋,廠商可能在快篩真正效期前、訂安全期限,但過了快篩效期,無人能知產品真正效期,是1天、1周、1個月還是半年,呼籲持有免費過期快篩者,就當一般廢棄物丟棄。中華民國基層藥師協會理事長沈采穎說,薛瑞元宣稱發放免費快篩是「在假設藥局同意服務民眾的情況下的決策、藥局有意見就向疾管署反應」,但基層藥局樂意服務民眾,只是訊息突如其來,負責調查意願的藥師公會全聯會作法又有別以往,只要藥局未回覆「不發放」藥局,就視同「願發放」,藥局收到貨才發現是即期品,會抱怨「強迫中獎」也就在意料中。基層藥師協會理事長沈采穎呼籲衛福部,應該儘快發送年底才到期的150萬劑庫存快篩,不要再等到淪為即期品才讓藥局及民眾「清庫存」。(圖/趙世勳攝)

手術、分娩陣痛用麻醉劑「不純物近上限」 食藥署回收3.3萬支
衛生福利部食品藥物管理署今(20日)公告回收「芯奔注射液10毫克」(Bain Injection 10mg/ml)。該藥品主要用於解除中度到嚴重疼痛,也可作為平衡麻醉的補助劑,如手術前後之麻醉,及在分娩陣痛過程中的產科麻醉。經廠商主動通報,部分批號藥品於進行持續性安定性試驗時發現不純物項目檢驗結果趨近規格上限,故啟動預防性回收。據了解,華宇藥品股份有限公司生產的「芯奔注射液10毫克」(Bain Injection 10mg/ml),許可證號為衛署藥製字第048167號,其主成分為NALBUPHINEHYDROCHLORIDE,主要用於解除中度到嚴重疼痛,也可作為平衡麻醉的補助劑,如手術前後之麻醉,及在分娩陣痛過程中的產科麻醉。經廠商主動通報,批號BCG291之藥品於進行持續性安定性試驗時,發現不純物項目檢驗結果趨近規格上限,故啟動預防性回收,總計回收3.3萬支安瓶。食藥署提醒,民眾倘對使用之藥品有任何疑慮,應盡速回診與醫師討論,處方其他適當藥品,同時請各醫療院所、藥商、藥局配合辦理回收作業,立即停止調劑、供應。食藥署副署長王德原說明,不純物是藥品主成分氧化、代謝自然生成,並不會影響藥物效果,但業者擔心後續數值超標,因此自主通報回收。至於藥物供貨方面,王德原指出,該藥物健保年度用量為22萬支,市占率約55.6%,目前業者還有庫存,加上國內還有其他替代藥品,所以不會出現缺藥問題。

醫院輸液供應告急 衛福部明與廠商討論 薛瑞元揭2重點
國內輸液大廠「永豐化學」涉嫌造假產品實驗數據,違反PIC/S GMP遭勒令停業,掀起供應危機並影響手術、住院患者權益,衛福部長薛瑞元今(19日)表示,食藥署及健保署將於明天邀集廠商討論增加產能、相關價格議題。薛瑞元表示,明天的會議會就藥證情況、增加產能、價格等方面與廠商討論;準衛福部次長林靜儀則表示,會確保臨床輸液供貨業務進行,食藥署也已控貨避免囤量,與啟動專案由他廠供貨。另今年4月已調漲葡萄糖注射液,未來是否調整藥價將另案討論。健保署副署長龐一鳴則指出,永豐及其他廠商、醫院端仍有庫存,尚未實際發生斷貨情況;另該署與食藥署會議任務不同,將分開進行討論,健保署將請有意專案製造廠商議價。而根據「西藥供應資訊平台」,國內共有5間廠商南光、東生、台灣大塚、台裕、濟生,提供替代藥品,永豐亦有部分藥品庫存可供應,食藥署副署長王德原表示,明天會議主要會請廠商盡量擴大產能。健保藥價依循DET(藥品費用支出目標制)調整,如超出藥費支出目標額度,便會依市場調查及交易價格調整。但藥師公會理事長黃金舜表示,藥價年年遭健保署砍價,其中9成屬老藥,且新藥與老藥利潤不同,部分藥品核價過低,使部分有藥證藥廠不願生產,或生產時偷工減料,應該檢討藥價制度,並分開議價新、老藥。對此,薛瑞元表示已在檢討DET;龐一鳴則指此涉及「全民健康保險藥品價格調整作業辦法」及「全民健康保險藥物給付項目及支付標準」,上週已和藥師公會討論相關事宜,預計修正草案將於今年中旬提出,方案確定才能決定明年藥價。

重鬱症藥物「忻樂膠囊」遭爆致癌物超標 食藥署下令廠商完成回收作業
食品藥物管理署於29日表示,重鬱症、廣泛性焦慮症用藥「忻樂膠囊」30mg,因內含有亞硝胺不純物恐有致癌風險,因此食藥署要求啟動回收機制,要廠商在1個月內完成回收作業。根據食藥署資料顯示,衛部藥輸字第028087號的忻樂膠囊30毫克(pms-DULOXETINE Capsules 30mg),因內含過量的亞硝胺不純物,超出可接受限量值,故啟動回收機制,要求廠商在5月17日前完成回收作業,同時要繳交回收成果報告書及後續預防矯正措施。資料中也提到,忻樂膠囊30毫克內主要成分是DULOXETINE HYDROCHLORIDE,主要用於重鬱症、廣泛性焦慮症、糖尿病周邊神經痛、纖維肌痛。如民眾對倘對使用之藥品有任何疑慮,應盡速回診與醫師討論,處方其他適當藥品。根據媒體報導指出,食藥署副署長王德原表示,本次主要是17日收到加拿大主管機關的通報,指稱該藥廠在進行安定性實驗時,發現當中含有過量的亞硝胺不純物,因此最後決定啟動國內回收作業。本次回收的忻樂膠囊30毫克所屬批號為646038,效期為2025年1月30日,銷售數量共計600瓶,每瓶100錠,總共6萬錠。該藥品在2023年的健保申報量為10萬479顆,市佔率0.328%,目前市場上同成分、同劑型、同劑量的藥品許可證還有9張,因此本次回收不會造成缺藥問題。

不再區分一般、特定用途 化妝品將在7月起單一管理
化粧品管理將邁入新時代!目前我國將化粧品分為一般和特定用途兩種,特殊用途化粧品如防曬品、染燙髮劑等,但由於消費者不易辨識,食藥署將自今年7月1日採「單一管理」,不再區分化粧品類別,業者完成登錄才能製造、販售、輸入、贈送等,否則可裁處1到100萬元罰鍰。食藥署表示,目前我國化粧品管理分為兩類,防曬品、染燙髮劑等特定用途化粧品,上市前須先向衛福部申請查驗登記,但考量國際間無類似做法,因此將自今年7月1日起,比照歐盟、美國、東協、加拿大等,以單一類別進行管理。食藥署科長醫療器材及化粧品組張家榮說明,今年7月1日起,所有化妝品上市前須先到「化粧品產品登錄平台系統」完成登錄,消費者亦可使用該平台查詢產品相關資訊。食藥署副署長王德原表示,目前僅針對特殊用途化粧品加強管控,一般化粧品則沒有。但今年7月1日起,所有化粧品只要沒有完成登錄,就不能製造、輸入、贈送、陳列供試用,相關用途通通不可以,否則可處1到100萬元罰鍰,且可以連續罰。另外,食藥署將分三階段請業者建立產品資訊檔案,今年7月1日先針對原本的特定用途化粧品,明年7月起針對嬰兒用、唇用、眼部用、非藥用牙膏、漱口水等一般化粧品,後年7月則是其他免辦理工廠登記的所有化粧品。張家榮說明,化粧品產品資訊檔案應包含16項資料,如產品登錄證明、全成分及含量、製造方法和流程、不良反應資料、產品安定性試驗報告等,並導入安全資料簽署人員制度,簽署人員須具備相關學歷,並完成54小時訓練課程,以及每年回訓8小時。食藥署也提醒消費者,若發現有不良品或使用時發生不良反應,可通報食藥署建置的「藥物食品化粧品上市後品質管理系統」,或撥打通報專線02-2521-5027。

剛開工又傳缺藥! 干擾素、疱疹藥告急
春節後剛開工,又傳缺藥!今年2月以來,食品藥物管理署陸續刊登公開徵求訊息,包括用於B、C型肝炎治療的干擾素、抑制疱疹病毒感染的針劑藥物、治療黴菌感染的眼藥水,以及癌症化療藥物都上榜,請有意願專案進口或製造的廠商在3月前聯繫。為保障民眾用藥權益,衛福部食藥署去年4月成立「藥品供應通報處理中心」,如接獲藥品短缺通報,經評估無建議替代藥品,就會公開徵求廠商專案進口或製造替代藥品。食藥署統計,截至去年底共接獲600多件藥品短缺通報案件,經調查有9項無替代藥品,啟動公開徵求程序。但根據西藥供應資訊平台,光是今年2月就有4件藥品公開徵求訊息。食藥署副署長王德原說明,「Interferon alpha-2a注射劑型」是干擾素藥物,用於癌症、慢性肝炎治療,每年健保用量約7200支,由於國內唯一持有許可證的藥商已於110年申請註銷,自此開始公開徵求專案輸入。「Ganciclovir 注射劑型」是抑制疱疹病毒感染的針劑藥物。王德原表示,該藥品每年健保用量約5.5萬支,目前國內共有2張許可證,其中原廠藥去年5月因製造廠生產問題,有短缺供應情形,國產藥則持續生產,但近期因設備維修,可能延誤生產,因此啟動預防性公開徵求,但目前並未缺藥。「Natamycin眼用製劑」用於治療黴菌引起的瞼角炎、結膜炎及角膜炎,國內僅1張許可證,每年健保用量約200瓶。王德原說,2月1日接到廠商通知,由於國際航班因素,無法確定航運延誤時程,因此啟動公開徵求。至於癌症化療藥物「Melphalan注射劑型」,適應症為局部惡性黑色素瘤、軟組織肉瘤、多發性骨髓瘤、卵巢癌、神經母細胞瘤,每年健保用量約1800支。王德原說,該藥品僅有1張許可證,由於國外廠在109年10月開始轉廠程序,因此食藥署自110年開始持續公開徵求,目前專案進口藥物還有庫存。