消滅癌細胞
」 癌症 乳癌 肺癌
醫療新躍進3/抗癌利器納健保「省千萬藥費」 異體移植讓存活期增5倍
去年11月,健保署正式將CAR-T藥物納入健保,70歲的張女士成為首位受惠的癌症患者,4億個基因改造的細胞正在她體內癌細胞作戰。基因嵌合T細胞治療(Chimeric Antigen Receptor T-cell;CAR-T)是近年來癌症治療的一大利器,先將患者的T細胞改造後,再輸回病人體內,讓CAR-T細胞啟動免疫機制攻擊及消滅癌細胞,過去這項治療需自費上千萬元,健保給付後將讓生存權不再被金錢決定。不只如此,國內更有醫學中心研究出「可異體移植」的CAR-T治療,動物實驗顯示可讓肺癌、乳癌、大腸癌的癌細胞消失近9成,存活時間延長3~5倍,不過須等《再生醫療法》通過,才能應用治療。2012年美國有位小女孩Emily,在罹患了急性淋巴性白血病之後,成為全球第一個接受CAR-T細胞治療的兒童。檢查顯示她體内的癌細胞已經完全根除,這11年來每一年Emily都會PO一張照片,向全世界宣告自己沒有受到癌症的侵襲,又健康的活過一年。2022年4月,台大醫院成為台灣首家提供CAR-T細胞治療之醫學中心,也有了第一位接受CAR-T細胞治療的小女孩亭亭。亭亭當初因兒童B細胞急性淋巴性白血病住院治療,如今已完全康復。在這之後,目前多家醫學中心如林口長庚台中榮總、中國醫藥大學附設醫院、花蓮慈濟醫院等皆有此療程。2024年1月2日,花蓮慈濟醫院為全台第一位健保給付CAR-T治療受惠的瀰漫性大B細胞淋巴瘤病人張女士,進行CAR-T細胞治療。「70歲的張女士9年前被診斷瀰漫性大B細胞淋巴癌,3年前接受化療、也接受自體脊髓移植,當時癌細胞一度消失,沒想到去年9月再次復發。」花蓮慈濟醫院幹細胞與精準醫療研發中心主任李啟誠說。當時張女士身心俱疲,與醫師、家人討論後,決定進行CAR-T細胞治療。李啟誠說,現在臺灣有這個能力可以進行CAR-T細胞治療,所以,在這次安排化療之前,一開始先讓張女士調養身體,以收集好的免疫T細胞,2023年11月,由專機送往瑞士進行基因轉殖處理並大量複製,12月21日製成結束後,21c.c.總共4億個經過基因改造戰力大為升級的CAR-T細胞,再由專機送返花蓮慈濟醫院,再將製備過後的CAR-T細胞回輸進張女士體內。CAR-T細胞治療雖是抗癌利器,但目前僅限於血液癌症。中國醫藥大學附設醫院院長兼細胞治療轉譯中心主任周德陽表示,逾9成癌症患者是實體腫瘤,如肺癌、大腸癌、乳癌等,實體癌細胞如同一座城堡,免疫細胞難以入侵,再加上同一顆腫瘤裡,每個細胞抗原表現可能不同,因此單一標靶的CAR-T細胞,無法有效清除癌細胞。CAR-T藥物原本須自費上千萬元,去年11月健保署正式納入健保,70歲的張女士成為首位受惠的癌症患者。(圖/花蓮慈濟醫院提供)歷經近20年努力,周德陽與研究團隊研發「可異體移植、非病毒基改之多靶向奈米抗體- CAR.BiTE-T免疫細胞治療」,簡單來說,就是隨取隨用的異體移植CAR-T治療,病人檢驗完成當天馬上使用,CAR.BiTE-T細胞治療可有效滲透到實體癌內部,並分泌BiTE(雙導向T細胞活化抗體)激活周邊免疫細胞,共同對抗癌細胞,在肺癌和三陰性乳癌小鼠模式中,有效延長3~5倍生存時間,甚至有一段時間內癌細胞幾乎消失。該研究成果今年三月獲權威國際期刊《先進科學(Advanced Science)》接受刊登,目前在美國等多國進行專利審查,已技轉給生技公司,預計今年內展開臨床試驗,應用於肺癌、大腸癌和三陰性乳癌等癌症患者的治療。不過,由於此療法需要「異體移植」,還需要《再生醫療法》草案通過,未來才能適用於治療上。
神經內分泌瘤新曙光 核素治療「精準消滅癌細胞」
今年10月基隆長庚血液腫瘤科及核子醫學科共組照護團隊,成功執行了「神經內分泌瘤肽受體放射性核素治療(Peptide Receptor Radionuclide Therapy, PRRT)」,為這類罕見腫瘤的病人帶來全新的治療選擇,更是神經內分泌瘤走向精準治療的重要里程碑。這位病人為居住基隆的63歲男性,罹患直腸神經內分泌瘤多年,曾接受過手術、賀爾蒙治療及數十次的化學治療,今年8月因腹脹、體重持續下降及長期化療相關副作用來醫院求診。經檢查診療後,醫療團隊綜合評估病人狀況,安排核素治療(PRRT)。在實際治療前,病人先接受體抑素受體正子掃描與氟化去氧葡萄糖正子掃描,確保體內的神經內分泌瘤適合接受核素治療,也做了抽血檢驗,確認造血功能、肝臟及腎臟功能符合標準。10月3日治療當天,過程中並未出現傳統化學治療的噁心、嘔吐、疲倦與掉髮等副作用,完成治療藥物注射後,在觀察一晚後平安出院,返家休養。目前病人在治療後主觀感受良好,雖偶爾有夜間盜汗的情況,但經過藥物治療後有所改善。病人能夠每天維持兩小時的散步習慣,此治療對其他正常生活作息的影響相對較小,因此得以繼續保有良好的生活品質。基隆長庚醫院內科部副部長暨癌症中心主任張沛泓醫師指出,神經內分泌瘤是一種罕見的腫瘤,根據衛生福利部109年癌症登記報告顯示,當年度新診斷個案數為1,963人,占所有癌症約3.9%。這類腫瘤可以在人體許多器官中發現,8成以上會發生在消化道如胃、小腸、大腸、胰臟等處,可依據腫瘤是否分泌荷爾蒙,分為「功能性」及「非功能性」。張沛泓醫師解釋,有症狀表現的患者,多半都是「功能性」的神經內分泌症狀發現異樣,病人可能面臨諸多原因不明之不適症狀,包括各類荷爾蒙分泌導致熱潮紅、低血糖、腹瀉、腹痛、氣喘等等,嚴重影響生活品質。「非功能性」的神經內分泌瘤由於大部分病人沒有明顯症狀,不容易察覺,往往是健康檢查作胃鏡、大腸鏡時意外發現,因症狀不明顯,被診斷出來時,常常已有遠端轉移狀況而無法透過手術切除。此時必須根據腫瘤分化狀況及疾病進展情形,搭配賀爾蒙、標靶、化療或是免疫療法;若治療效果不佳時,核素治療技術便是治療的選項。基隆長庚核子醫學科主任陳世欣醫師表示,神經內分泌瘤表面常具有豐富的體抑素受體,核素治療(PRRT)就是利用體抑素受體結合藥物進到癌細胞裡,再釋出放射線殺死癌細胞。這樣精準的腫瘤治療方式,可降低治療副作用,提升病人的預後和生活品質。陳世欣醫師強調,核素治療(PRRT)目前仍面臨一些挑戰,包括醫療團隊的醫師、放射師和護理師等,都需經過特殊培訓與合作,才能確保治療的安全和有效;同時治療的醫院需有特殊的安全設施,包括廢水處理、放射線屏蔽和放射活度監控等,並經過核能安全委員會的審核才能執行。基隆長庚團隊醫師鼓勵神經內分泌瘤患者不要放棄治療,現今醫療技術不斷進步,要持續治療才有可能戰勝疾病。民眾若有神經內分泌瘤相關問題,也應儘早至門診諮詢相關科別醫師,才能早期發現早期治療。

抗乳癌新武器「魔術子彈」 精準攻擊+旁觀者效應提升戰力
【健康醫療網/記者張慈恩報導】女性一發現乳房有腫塊,千萬不要拖延就醫!根據大林慈濟醫院血液腫瘤科李思錦醫師、嘉義長庚醫院血液腫瘤科呂長賢醫師的觀察,門診中,有些乳癌病患發現胸部有腫塊,常因逃避、害羞,或深深感覺自己做錯事等因素而拖延就醫,有些病患拖到腫瘤大如棒球、籃球,甚至出現傷口、分泌物,並產生異味,夏天還堅持穿厚衣服,且在傷口裹上厚厚紗布以掩蓋傷口、異味,都還是不願面對。李思錦醫師指出,近年來,隨著新藥推陳出新,乳癌病患即使遭遇癌細胞轉移,也都有藥物治療選項,讓存活期可以延長。所以病患若從接受疾病開始,改變心態,勇敢接受治療,並配合醫師指示用藥,生活還是可以回歸正常,病痛也能大幅減輕。HER2弱陽性病患,治療有了新選項談到乳癌的治療,呂長賢醫師表示,乳癌病患的治療策略與HER2(第二型人類表皮生長因子受體)、HR(荷爾蒙受體)、BRCA乳癌基因表現等有關。其中在乳癌病患中,HER2陽性病患約佔20%-25%,以這群病患為例,過去使用抗HER2標靶藥物,多數可發揮作用。「乳癌病患如何知道自己有沒有HER2表現?」對於這問題,李思錦醫師解釋,目前檢查HER2方式以「免疫組織化學染色法」(IHC)、「螢光原位雜交法」(FISH)為主,檢驗時可發現,HER2依據組織染色表現分為三價、兩價、一價與零價,價數越多,代表HER2表現越多越明顯。李思錦醫師進一步分析,在過去,當HER2組織染色呈現三價或FISH陽性,才被視為「HER2陽性」,此時才有對應的抗HER2標靶藥物可供使用,如果HER2組織染色呈現兩價FISH陰性或染色為一價,以前都被當成HER2陰性處理,在乳癌病患中,所佔比率達50%,但在乳癌治療精準化的現在,治療趨勢已經有所改變。目前,不少研究顯示,若是HER2組織染色呈現一價、兩價等「HER2弱陽性」的病患,使用新一代ADCs(抗體藥物複合體,又稱魔術子彈)藥物,同樣可發揮毒殺癌細胞的效果。新一代魔術子彈精準攻擊,病患存活希望大大增加據統計,HER2陽性病患若使用新一代ADCs藥物,無疾病惡化存活期有機會長達2年半,若是HER2弱陽性病患用藥,與傳統化學治療相較,無疾病惡化存活期增加一倍,這代表傳統HER2陽性與HER2弱陽性病患相加,有高達70%到75%的乳癌病患將有機會受惠於新一代ADCs藥物治療,對於具HER2表現的轉移性乳癌病患而言,無論HER2表現是強、是弱,都有新治療選項可供選擇,病患延長生命的機會再度增加。針對抗體藥物複合體的獨特作用方式,呂長賢醫師表示,新型ADCs藥物的結構有HER2抗體、連結子,而連結子帶有細胞毒殺藥物。這類藥物進入體內,因帶有HER2抗體,一找到有HER2陽表現的細胞,受體、抗體就會結合,癌細胞就會把藥物「吃進去」。此時癌細胞內的酵素,會切斷ADCs上的連結子,帶有細胞毒殺藥物便順勢進入、釋放毒性,很快消滅癌細胞,不只如此,這些細胞毒殺藥物也會穿過癌細胞細胞膜,滲入周遭的癌細胞,導致旁邊癌細胞也跟著毒發身亡,這種效應稱為「旁觀者效應」(Bystander Effect),藥物作用範圍就可擴及更多癌細胞。李思錦醫師表示,這類藥物的作用方式,由於攻擊精準,所以與傳統化療藥物相比,副作用比較輕微,如果是身體較虛弱的病患,也有機會可使用。不過藥物可能產生間質性肺炎,在用藥過程,需監控血氧濃度,發現血氧濃度異常,就必須提高警覺。醫院團隊、病友團體支持,病患更有前進動力在治療乳癌的過程中,病患的肌力維持與身心靈支持,都是重要環節。以大林慈濟醫院來說,特別針對乳癌病友提供肌力提升課程、復健課程等,讓病患學習;嘉義長庚醫院則有堅強的病友團體作最佳後盾。兩院也都有個管師、營養師等專業人員予以協助。李思錦醫師呼籲,當發現乳房有腫塊、異常,一定要勇敢踏出、尋求治療,只要願意勇敢踏出第一步,就有生命延長的可能性。呂長賢醫師則提醒,民眾如果符合國民健康署免費乳癌篩檢資格,一定要定期接受乳癌篩檢,早期發現,也才能早期治療,存活期也才能真正大幅提升。

早期肺癌拚治癒!掌握「免疫檢查點檢測」關鍵
【健康醫療網/記者王冠廷報導】在影像篩檢的進步與普及下,國人早期確診肺癌比例大幅提升,雖然越早發現越可能接受手術切除,提升治癒機會,但其實肺癌的高復發率仍然讓人提心吊膽!醫師坦言,即使是第一期的五年復發率也高達45%,也難怪肺癌連年高掛十大癌症死亡榜首。所幸,過往僅被運用在晚期的精準治療,已被證實對降低早期肺癌復發有幫助,包括目前最受矚目的免疫治療,患者在接受免疫檢查點檢測後,也有機會可評估使用,更徹底消滅體內殘存癌細胞,爭取最佳痊癒機會。輔助治療要更精準!勿忘「手術前」就要先問PD-L1篩檢「相較於其他實體腫瘤,肺癌本來就比較容易復發!」林口長庚肺腫瘤及內視鏡科教授郭志熙醫師分析,期別越晚復發機率越高,第二期的五年復發率提升到60%,即使是可手術的第三期也高達75%,「面對如此高的復發機率真的會為病人擔心,也希望能有更多治療武器,但過去二十年來的術後輔助治療,說實話效果差強人意。」早期肺癌術後輔助治療雖已行之有年,但長久以來都僅以化療為主,約僅能降低5%的復發機率,終於近年迎來重大突破!郭志熙醫師表示,精準治療已發展到早期肺癌領域,現在輔助治療也逐步建立應進行基因和免疫檢查點檢測的觀念,包括EGFR、PD-L1等都是決定用藥的重要指標。「其中PD-L1因為一定要取腫瘤切片才能進行,所以一定要手術前提早跟主治醫師討論篩檢,以免後續面臨檢體不足的窘境,錯失選擇機會」郭志熙醫師特別提醒。破解癌細胞「偽裝」:免疫治療喚醒殺手T細胞談到免疫治療PD-L1抑制劑的機轉,郭志熙醫師形容,就好像是一場免疫細胞與癌細胞的諜對諜戰爭。人體的免疫系統為了維持平衡,有一個「煞車」機制,也就是正常細胞會以自身的PD-L1配體與T細胞上的PD-1免疫檢查點結合,使T細胞不會誤殺正常細胞;而癌細胞就是運用這個機制,藉由PD-L1過度表現來「偽裝」,誤導T細胞。此時為了破解癌細胞的偽裝,就可以使用PD-L1抑制劑,解除免疫的煞車機制,等於是喚醒T細胞,使其繼續完成消滅癌細胞的任務。「因此PD-L1是否過度表現就會與用藥成果息息相關,通常PD-L1表現越高,治療效果也會越好」郭志熙醫師進一步解釋,當早期患者的EGFR、ALK無表現,但PD-L1有表現(PD-L1 TC ≥1%)時,就可以考慮在術後化療結束後,再接續一年的PD-L1抑制劑治療,讓可能殘存的癌細胞進一步被殲滅。根據大型臨床試驗顯示,加上PD-L1抑制劑作為輔助治療,可幫助具PD-L1表現之患者降低超過3成之復發機率,針對PD-L1高表現者(PD-L1 TC ≥50%)更有機會將復發風險大幅降低達5成5以上。PD-L1抑制劑有效降低復發率 延長整體存活期有望郭醫師也分享其門診的真實案例,一名近70歲開完刀確認為第三期之男性患者,因PD-L1表現高達70%以上,故化療後決定再使用PD-L1抑制劑,後來順利完成一年的療程,期間腫瘤指數一路穩定下降,目前已降到正常值,無須再用藥,僅須持續追蹤。「早期肺癌術後免疫治療還在持續發展和追蹤成效中,目前已經證實對降低復發有確切效果,根據試驗的期中分析來看,對於延長整體存活期也呈現有助益的傾向,未來成果值得期待。」郭醫師也提醒,早期確診早期治療仍是肺癌拉長存活期的關鍵,針對老菸槍、有家族史等高危險族群,應善用低劑量電腦斷層,以提早發現較小的病灶;確診後也切勿灰心,癌症醫療現已大幅進步,建議患者多與醫師討論各種治療選擇,並提早進行個人化醫療的相關檢測,掌握用藥先機,方能成功戰勝肺癌。
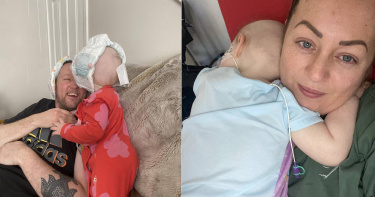
女嬰眼皮冒詭異瘀青「1個月變黑眼圈」 檢查竟是第4期癌症
身體出現任何不尋常,都不容輕易忽視。英國有一對夫妻,發現1歲多小女兒的右邊下眼皮出現瘀青,隨著時間變成了黑眼圈,結果就醫檢查發現是癌症。根據《鏡報》報導,38歲人妻珍妮(JennyHuddart)與小2歲丈夫亞當(Adam Walker)今年2月發現,年僅13個月的女兒右眼底下有一小塊瘀青,過了4個禮拜後,瘀傷逐漸變大,變成了黑眼圈。他們注意到這個變化,左眼卻沒有,看起來十分不協調,因此覺得有點擔心,於是帶孩子去看醫生,得到的結果卻是很健康,沒有任何問題。然而,珍妮還是感覺不對勁,後來要求轉診到眼科,預約4月底看診。但時間都還沒到,女兒的眼睛變得更加不協調,他們馬上打電話將孩子送醫,進行了掃瞄檢查後,證實是第4期的神經母細胞瘤,是由身體多個部位的未成熟神經細胞發展而來的癌症,癌童20年存活率僅3成。女嬰正在積極進行治療。(圖/翻攝自Harper’s Army22臉書)醫生解釋,癌症從女嬰腎臟的腎上腺開始,擴散到四肢、肋骨、臀部、頭骨和骨髓中。這讓珍妮和亞當震驚不已,彷彿世界都停止了,隨後立刻安排治療,動手術切除腫瘤細胞,小小年紀卻要接受高劑量的化療,取出並冷凍幹細胞,以幫助長出新的、健康的細胞。女嬰必須接受免疫療法,來消滅癌細胞,完成治療後,珍妮和亞當正在等待結果,確認是否切除了腫瘤或進行高劑量化療,「因為她的血小板一直很低,必須每3天計算一次血球,所以她接受的輸血,比我計算的還多」,他們祈求掃描顯示反應良好,那就代表癌症已經減輕,更希望的是癌症不見了,即使知道是不切實際的想法。

賴基銘教授投入中山天明細胞治療中心 癌症治療的新選擇!
在癌症的醫療旅程中,治療方法的選擇對於存活率與生活品質至關重要。中山天明細胞治療中心,位於臺北中山醫院並與天明製藥股份有限公司(股票代號:6659,下稱:天明製藥)共同成立,由賴基銘教授擔任主治醫師與中心院長,將傳統醫學與最新的免疫細胞治療技術結合,成為患者在抗癌之路上的新希望。免疫細胞治療是癌症治療的新趨勢,這種療法利用病人自身的免疫細胞,經過合規製備場所的大量擴增後,已具有偵查與毒殺癌細胞的功能,進而回輸到體內來對抗癌症。賴教授介紹道:「中山天明細胞治療中心引進免疫細胞技術,就像訓練新兵一樣,這些活化後的免疫細胞擁有特定功能,與現行的常規治療及標靶治療結合,形成整合治療的新選擇。」天明製藥的NK自然殺手細胞與毒殺型T細胞,最大的差異在T細胞需要透過「主要組織相容性複合體第一型」(MHC Class I)的辨認才會啟動專一性毒殺能力;但詭譎的癌細胞往往會戴上各種抑制面具,使得T細胞無法正常發揮。NK自然殺手細胞一旦被活化,就會開始毒殺癌細胞。中山天明細胞治療中心負責人賴教授,不僅是免疫學和腫瘤學的專家,更積極參與免疫細胞治療相關的研究工作。(圖片提供/CTWANT拍攝)相較於傳統局部性治療,免疫細胞治療是一種全身性的治療。透過靜脈輸注擴增的免疫活細胞,強化免疫系統來對抗癌細胞。賴教授強調:「免疫細胞治療是未來的希望,因為在確診時,腫瘤往往已經發生遠處轉移,單一的局部治療,及隨後的全身性化學治療或標靶藥物,可能無法徹底消滅癌細胞。免疫細胞治療的優勢在於能夠精準針對全身性的癌細胞進行攻擊,從而提高治療效果。」然而,免疫細胞治療並非適用於所有癌症患者,因為這種治療方式需要根據患者的癌細胞特徵進行訂製。賴教授指出,患者的醫療團隊需要仔細評估每位患者的病情、免疫狀態以及相關的檢測結果,才能確定是否適合接受免疫細胞治療。為了確保免疫細胞治療的成功,中山天明細胞治療中心的醫師團隊具備相應的專業背景和經驗。賴教授自己就是免疫學和腫瘤學的專家,並且積極參與免疫細胞治療相關的研究工作。此外,團隊中還包括腫瘤科醫師、臨床試驗專家、實驗室技術人員等不同專業領域的人員,以確保免疫細胞治療在臨床應用中的高效性和安全性。賴基銘教授說明中山天明細胞治療中心致力於為癌症患者提供最先進的治療技術和個體化的治療方案,目標為患者安排更優良、更有效的治療計畫。(圖片提供/CTWANT拍攝)目前臺灣醫療選擇多元,北醫有質子治療、萬芳有熱治療、北榮有重粒子治療,中山醫院為地區醫院,相對來說有更多的選擇性與醫學中心合作,讓患者在需要接受免疫細胞治療時,可安排更優良、更有效的治療計畫。賴教授表示,作為一名臨床醫師和研究人員,他致力於將最新的科學研究成果轉化為臨床應用,其過去針對中草藥的研究基礎,已發表近20篇論文,研究發現,要清除癌幹細胞,中西醫整合是有加乘互補作用,提供「癌症整合輔助醫學」Cancer Complementary & Integrative Medicine(CIM),通過醫學研究和臨床實踐的相互促進,為患者提供更好的治療選擇。 賴基銘教授指出,過去父母在日治時代都曾接受過簡單的醫藥訓練,父親開藥房、母親自行研讀日文書研發感冒藥;但因雙親都不是醫師背景,便期待家中的三個兒子都能從醫。大哥賴東淵是中醫博士、弟弟賴易成後來走放射腫瘤科,自己則走西醫腫瘤科,女兒跟女婿都走放射腫瘤科,三兄弟跟下一代都在臨床研究範疇與癌症治療相關。賴基銘教授指導就臨床醫師背景與天明製藥成立生醫部團隊,針對臨床與製程整合提供國人更理想的方案。(圖片提供/CTWANT拍攝)中山天明細胞治療中心致力於為癌症患者提供最先進的治療技術和個體化的治療方案。免疫細胞治療作為其中的一項重要選擇,為患者帶來了新的希望。透過賴基銘教授和他的團隊的專業知識和經驗,以及中山醫院與其他醫學中心的合作,讓國內外的患者可以獲得高效且安全的免疫細胞治療,提高生存率和生活品質。

終結癌症1/「核彈級武器」精準鎖定癌細胞 免開刀治療4次「腫瘤已消失」
長榮集團創辦人張榮發生前罹患肝癌,赴日做重粒子治療痊癒後,曾捐2億美元想在台灣建立重粒子治癌研究院,可惜卡在法規未能如願。事隔9年,斥資45億元的台北榮總「重粒子癌症治療中心」,今年5月15日終於啟用,這間台完第一座、全球第14座重粒子中心,可治療肺癌、肝癌等14類癌別,如同「核彈級武器」可精準消滅癌細胞,讓台灣癌症治療進入新里程碑。74歲的童先生因B肝合併輕微肝硬化而在醫院定期追蹤,後來發現右肝有2.6公分大的腫瘤,童先生沒告訴家人、也不願開刀,覺得生死有命不必強求,台北榮總重粒子放射腫瘤部賴宜君醫師邀請童先生加入重粒子治療臨床試驗,由於不需開刀,因此童先生擲筊問神明後決定接受治療,1周內完成4次照射,2.6公分腫瘤消失,除了皮膚表面泛紅,並無其他不適,至今追蹤半年未再復發。目前癌症治療方式包含外科手術、化療、栓塞、電燒、標靶、免疫、放射治療等,重粒子治療屬於放射線治療的一種。不同於傳統放射治療採高能量X光或電子束,重粒子可將碳離子加速至光速70%的速度,再對腫瘤細胞進行集中照射。此外,重粒子射線具有獨特的「布拉格峰」(Bragg Peak)特性,不會在入射初期與體表產生能量,而是在預定的組織深度後,才精準釋放最大能量,摧毀癌細胞。打造重粒子治療中心所費不貲,醫院透露光是一個月的電費就需花費200萬元,目前治療也採自費模式。(圖/劉耿豪攝)重粒子治療科主任藍耿立表示,極惡性的腫瘤會呈現缺氧狀態,重粒子則對缺氧癌細胞殺傷力很強,堪稱是放射腫瘤界的核彈級武器。舉例來說,光子治療通常需要經歷30次左右的照射,而重粒子治療的照射次數僅需一半左右。賴宜君說,重粒子治療適合不能開刀或拒絕開刀、且影像檢查可看到腫瘤者,照射次數從4~16次不等,一般肺癌和肝癌大約做4次照射,其他如無法開刀的胰臟癌也適合做重粒子治療。目前已完成攝護腺癌、脊索瘤、胰臟癌、肝癌、肺癌、唾液腺癌等12例臨床試驗,患者病況穩定,部分癌症縮小甚至消失。台北榮總副院長李偉強表示,欲接受重粒子治療需先進行評估,再製作固定身體部位的模具、電腦斷層模擬定位等,治療次數視癌症大小、位置等狀況而定,一週可治療4天,每次療程需要30分鐘,原則上不用住院。不過,由於重粒子設備維護昂貴,目前治療也無健保給付,所以自費價格約60~150萬元,並不便宜,北榮也承諾1年將會保留2%名額提供弱勢癌患免費治療。

膽道癌初期症狀輕 成隱藏版「癌王」發現多半以晚期
膽道癌對國人而言相對陌生,但並非罕見癌症,也很常與胰臟癌搞混。現年57歲的劉先生是中藥行老闆,五年前開始出現消化不良,進食就脹氣,起初自行抓中藥治療,症狀時好時壞持續了半年才就醫,醫師發現他眼睛明顯發黃,進一步檢查確診為肝內膽管癌第三期,當時腫瘤已有10.5cm,研判無法開刀摘除,所幸在醫師評估下參加免疫療法合併化療臨床試驗,腫瘤明顯縮小,腹痛、黃疸症狀也好轉。膽道癌不易早期發現 6-7成病友確診時已是晚期膽道癌又稱膽管癌,根據癌症登記年報顯示,新診斷人數逐年增加,其中又以60歲以上的年長者居多。膽道癌初期通常沒有徵兆或症狀不明顯,即使出現消化不良、腹部疼痛、食慾不佳、體重下降等症狀,也難以聯想到癌症,往往等到出現黃疸、全身搔癢、尿液變深或是糞便變淺等明顯症狀才就醫檢查,高達6-7成病友確診時已是晚期。台灣癌症基金會執行長賴基銘教授指出,國人對於癌王胰臟癌已經耳熟能詳,但同組的膽道癌卻鮮為人知,診斷上過去也常被界定是肝癌,由於膽道癌治療進展慢,且治療選項少,對於無法手術治療的膽道癌病友,在過去10多年來只有化學治療能選擇,以及局部輔以放療,其副作用也嚴重影響病友的生活品質,病友們皆殷殷期盼新興療法能夠突破治療困境。林口長庚紀念醫院血液腫瘤科系主任陳仁熙教授表示,膽道癌依腫瘤發生位置可分為肝內膽管癌、肝外膽管癌、膽囊癌及壺腹癌這四個類型。肝內膽管癌發生比率較高,膽囊癌次之。雖然腫瘤形成原因尚不明確,但目前已知風險因子包括:(1)長期導致膽汁鬱積的疾病;(2)罹患容易反覆造成膽道發炎的疾病:如原發性硬化性膽管炎或潰瘍性結腸炎;(3)慢性B型、C型肝炎或肝硬化;(4)特定肝吸蟲感染,如中華肝吸蟲;(5)經常接觸戴奧辛、多氯聯苯等有害物質;(6)膽管良性瘤,如膽管乳突狀瘤病;(7)肥胖;(8)糖尿病;(9)抽菸、酗酒,符合上述九大高危族群的民眾皆應養成定期檢查的習慣。確診即陷入困境 過往膽道癌存活期難突破一年在過去由於治療方式有限,膽道癌只分為可開刀與不可開刀,僅有不到3成病友可以接受手術治療,且術後容易復發,賴基銘教授坦言:「大部分病友2年內都會陣亡」,平均五年存活率僅10-30%左右。陳仁熙教授補充,對於無法手術只能接受化療的病友中,化療效果也不如預期,中位存活期僅有約8-10個月,晚期膽道癌的五年存活率小於5%,臨床治療棘手程度及高死亡率,使病友確診即陷入治療困境,急需新的藥物來突破現況。免疫療法登場救援 用於晚期膽道癌一線治療帶來新希望近年來,免疫療法已成為癌症治療新趨勢,不論是單獨治療或是合併其他治療策略,臨床應用上都有不錯的成果,今年(2023)也獲衛福部核准用於膽道癌治療。義大癌治療醫院血液腫瘤部副院長饒坤銘教授表示,免疫療法的治療原理是破壞癌細胞欺騙人體免疫系統的機制,使病友自身的免疫細胞得以重新辨識並消滅癌細胞。根據臨床數據顯示,免疫療法合併化療的使用可以顯著降低病友的死亡風險,3成病友不僅腫瘤明顯縮小,整體存活期超過1年,更有2成5以上病友存活期大於2年,打破膽道癌治療10多年來的困境。饒坤銘教授以前述個案劉先生為例,當時因腫瘤太大,若進行手術切除,剩下的肝功能將不足以支撐日常生活,因此在20多天的膽汁引流後,即加入免疫療法的試驗,兩次療程後劉先生都自覺狀況感善,腹痛減少。雖然期間因肝指數(GOT、GPT)上升一度中斷,不過治療不到1年就觀察到腫瘤明顯縮小,至今歷時3年多,原本10.5公分的腫瘤也僅剩2-3公分,就像一顆大蘋果縮減成只剩果核,幾乎沒有活性,良好的成效也令團隊感到振奮。膽道癌治療仍有進步空間 期許免疫療法及早納入健保給付免疫療法合併化療是膽道癌治療的重要里程碑,具有較佳的治療成效,病友對治療的耐受性也高,著實為晚期膽道癌治療帶來一道曙光,但新興治療所帶來的龐大經濟負擔對病友來說還是非常沉重。賴基銘教授、陳仁熙教授與饒坤銘教授共同期許免疫療法能及早納入健保給付,讓晚期膽道癌病友在治療選擇上多一個選項,進一步減輕病友的治療壓力。▲ 膽道癌衛教記者會大合照,(貴賓由左至右):林口長庚紀念醫院血液腫瘤科系主任陳仁熙教授、台灣癌症基金會執行長賴基銘教授、病友劉先生、義大癌治療醫院血液腫瘤部副院長饒坤銘教授

39歲女拚「做人」卻先迎來乳癌 不必二選一!治療後生下健康女娃
乳癌長年佔據女性好發癌症之首,而依據最新衛生福利部108年癌症登記報告統計,44歲以下確診乳癌的年輕癌友約17.23%,佔比不低。而乳癌的治癒率高,因此對於年輕乳癌病友最困擾的,多為面臨正值有生育規劃安排時罹癌,往往要面對癌症治療與生育計畫的兩難。39歲許小姐在結婚前就跟職場女性一樣以工作為重,32歲結婚,婚後並沒有特別避孕,原本希望能透過自然受孕方式來擁有「愛的結晶」,努力了三、四年肚皮始終沒有動靜,為了一圓當媽媽的夢想,跟先生討論也開始做不孕症治療。沒想到在36歲時,愛的結晶還沒來,卻先迎來了乳癌。當確定是乳癌那一刻,她哭著問醫生:「我很想要生小孩,怎麼辦?接受治療後,我是不是再也無法懷孕生小孩了?」她回憶著醫生當時告知,化療可能影響卵子品質、讓卵巢受損,想生小孩要趕快預作準備:冷凍卵子、冷凍胚胎做生育保存計劃,夫妻倆抓緊時間在治療前冷凍了10個胚胎。考量自己年近40歲受孕不易,許小姐想盡快準備懷孕,因此趕在做完12次化療及標靶治療後,跟醫師商量是否有機會可以暫時停藥去準備懷孕。原本要吃5年的抗荷爾蒙藥,與醫師討論後先吃1年後先暫停去準備懷孕。而當醫生宣布「中獎」受孕成功的那天,在診間興奮歡呼,回家把囤貨很久的驗孕棒拿出來「狂驗好幾次,看到兩條線,真的會莫名感動!」現在,生下可愛的女兒,實現了當媽媽的願望,每週至少兩天,她會揹著寶寶一起爬山,「我要把自己鍛鍊得更強壯,好好陪寶寶一起長大。」年輕乳癌病友持續攀升,加上現代女性晚婚晚生比例高,高齡婦女求子不易,好不容易懷孕了,卻發現罹患乳癌,該怎麼辦?「為了治療,我是不是要把小孩拿掉?我可以先選擇把孩子生下來之後再接受治療嗎?延緩治療是否也會讓病情急速惡化呢?」馬偕紀念醫院乳房醫學中心主任張源清醫師表示:在醫學科技的進展下,懷孕期間的乳癌治療與生育不需要二選一,早期病友原則上建議先手術處理腫瘤,不需要考慮終止懷孕。國際間具影響力的文獻報告顯示,一旦進入第二孕期,也就是滿 12 週之後,乳癌目前標準的化療方式對胎兒其實是安全的,不需要特別終止懷孕。若能積極接受並配合應有的手術與化學治療,病患存活率和相同臨床病理特徵的乳癌患者相當;研究也指出,在第二孕期後有接受乳癌化療產下的孩子,除了出生時體重稍輕,但整體健康、生長範圍、心血管功能、認知功能等都沒有差異。在懷孕時罹癌的病友可以在生產後再進行抗荷爾蒙藥物治療、標靶、放射線、免疫療法等。懷孕中罹患乳癌的照護需要多專科共同參與,治療計畫需更細心周全的考量,腫瘤科醫師必須與婦產科醫師密切溝通,觀察癌症治療過程中孕婦的生理變化。每個病友與家屬的人生規劃,都有賴良好的醫病溝通,共同討論以做出最佳治療方案。在現代醫療的協助下癌症已經不再是絕症,隨著癌症治療及生殖醫學技術進步,利用進步的生殖細胞冷凍保存科技,可以幫助癌症患者達到生兒育女的需求。TFC臺北婦產科診所生殖中心院長胡玉銘醫師表示,生育保存已是現今癌症治療的一環,當醫師面對年輕癌症病患,尤其是介於15-49歲的育齡患者,需先了解患者生育經驗及未來生育規劃,若有計畫懷孕,擬定治療計畫就會考慮生育時程,同時轉介癌友接受生殖醫學團隊評估。癌症治療需要與癌細胞搶時間,為了不耽誤治療,台灣生殖醫學會建議在癌症治療開始之前,評估以下生育保存方案的可行性:男性癌友1.精子冷凍保存:過程約需2小時,包含抽血檢測、留存精液、冷凍等。2. 顯微睪丸取精手術:約需10-20分鐘,利用睪丸組織切片取得精子,並冷凍保存。適用於無法射精、無精症、無精液症等年輕男性癌症病人。女性癌友 3.卵子冷凍保存:只要確認未懷孕的狀態即可進行,透過「隨時啟動」(Random start)的取卵技術,可不須配合受限於月經週期快速取卵,快速爭取時間。過程約需2週,包含:抽血檢測(傳染性疾病、荷爾蒙相關)、 藥物誘導排卵、追蹤濾泡成熟度(透過陰道超音波)、取卵手術、冷凍等保存。 已婚癌友4.胚胎冷凍保存:因台灣人工生殖法,僅限適用於已婚患者,過程約需2周,精卵在體外受精成為胚胎,再冷凍儲存。癌症療程完成後,什麼時候可以準備懷孕呢?TFC臺北婦產科診所生殖中心胡玉銘院長表示,在癌症治療結束的五年後,必須先經由原癌症主治醫師同意,確認安全無虞後,即可轉介至不孕症生殖專科與醫師討論並評估生育計畫。若先前已有品質完好的冷凍生殖細胞,可在解凍後開始接續的試管嬰兒療程。若當初沒有進行生育保存,也不用灰心,我們依舊能從頭開始嘗試,一切都是有機會的。當醫療不斷進步,癌症治療存活率愈來愈高,生育保存成癌症治療新課題,治療不只是消滅癌細胞,治療目標也不只停留在『活下去』而已。當走過癌症這個人生逗點,也要能滿足癌友們回歸社會的各項需求,即使罹癌也能勇敢面對、積極治療、甚至規劃安排自己未來的人生,擁有自主選擇與自我賦能的機會。

國衛院研發免疫治療候選藥物 可吞噬腫瘤「適用多種癌症」
癌症盤據國人十大死因之首已40年,國人罹癌率逐年攀升,傳統的手術治療僅能治療罹患局部腫瘤的病人,化學療法和放射線療法附帶許多不良副作用,癌細胞因持續基因突變產生抗藥性,並改變腫瘤微環境逃脫免疫系統監控,又讓標靶治療的效果打折。近年來針對正常細胞與癌細胞內外免疫機制的研究愈發清晰,利用調整腫瘤微環境強化免疫系統進而消滅癌細胞的免疫療法,是目前治療癌症更有針對性且有效的新興療法。國家衛生研究院生技與藥物研究所與中央研究院生物化學研究所共同組成的新藥研發團隊利用CD47-SIRPα axis作為標靶,成功開發新型強效口服用之小分子isoQC抑制劑,這類新型的isoQC抑制劑可以有效的抑制isoQC的酵素活性,進而減少腫瘤細胞表面上CD47與SIRPα的結合,增強巨噬細胞對癌細胞的吞噬作用進而達到治療癌症的效果,是適用多種癌症免疫治療的候選口服藥物。CD47是一種位於細胞表面的蛋白質,廣泛表現於正常細胞與癌細胞,當CD47與巨噬細胞表面的信號調節蛋白α (Signal regulatory protein α,SIRPα)結合,就會向巨噬細胞傳達『別吃我』的信號,用來當作一個免疫檢查點抑制巨噬細胞的吞噬作用。在過去的研究發現CD47廣泛在各種癌細胞表面大量表現,因此也被認為是癌細胞躲避免疫系統的一個關鍵。而麩酸胺環化同工酶(glutaminyl cyclase isoenzyme,isoQC)是CD47與SIRPα結合的重要調節因子,因此透過調控isoQC的作用就可調節巨噬細胞對癌細胞的吞噬作用。DBPR22998是由本研發團隊所開發的一個口服用的小分子isoQC抑制劑,已經證實對isoQC具有很強的抑制效果,並且在多種具有CD47高表現的腫瘤細胞株可以有效的抑制CD47與SIRPα-Fc蛋白質的相互作用。DBPR22998在人類monocyte-derived巨噬细胞中證實具有抗體依賴性細胞吞噬作用(antibody-dependent cellular phagocytosis)。在不同的固態腫瘤以及血液腫瘤動物模式實驗中證實DBPR22998與治療性抗體合併使用可以有效的增強抗腫瘤藥效。目前已有利用CD47單株抗體的癌症治療方式,然而CD47單株抗體會與正常細胞結合,因此需要高劑量才能抑制腫瘤細胞,然而高劑量的 CD47單株抗體會抑制紅血球細胞上的「別吃我」信號,促使巨噬細胞吞噬紅血球並引起貧血症。小分子isoQC 抑制劑不會引起紅血球細胞減少或血小板減少症,因此這類藥物避免了CD47單株抗體治療潛在的副作用以及風險,在癌症免疫治療上顯得更加的安全。此外isoQC 抑制劑可以製成口服藥物,製造方法相對較簡單而且成本較低。DBPR22998為癌症免疫治療領域首創之新穎、口服用的小分子候選藥物,適用於多種癌症治療,除了可以促進巨噬細胞吞噬腫瘤的吞噬效應,增加癌症治療的效果,在動物實驗中還延長了有腫瘤小鼠的整體平均生存時間,而且副作用較低,與單株抗體標靶藥物或免疫檢查點抗體藥物合併使用,可以治療容易復發且耐藥性高之癌症病患。DBPR22998已獲得美國、中華民國、日本、韓國、中國以及澳洲之專利核准,目前對於DBPR22998所進行之研究尚屬臨床前試驗階段(pre-clinical stage),期待與國內外生技產業進行技術移轉或產學合作共同推動臨床試驗,進而帶動生技新藥產業的成長及國際競爭力。

細胞治療突破!一次殲滅癌細胞軍隊 「戰勝白血病」女童慶10歲生日
2012年美國有位小女孩Emily,在罹患了急性淋巴性白血病之後,成為全球第一個接受CD19 CAR-T細胞治療的兒童。目前檢查結果在她身體内的癌細胞已經完全根除,這十年來每一年Emily都會PO一張照片,向全世界宣告自己沒有受到癌症的侵襲,又健康的活過一年了。2022年4月,臺大醫院率先成為台灣首家可提供正式臨床使用CD19 CAR-T細胞治療之醫學中心,在臺大醫院協助之下,台灣也有了第一位接受正式CD19 CAR-T細胞治療的小女孩亭亭。亭亭當初因兒童B細胞急性淋巴性白血病住院治療,在臺大醫院的治療及照護下,現在已經完全康復,展露笑容慶祝今年10歲生日與重生。癌症是兒童的第二大死因,台灣每年約有500位新發病癌症兒童,其中約2成屬於「兒童B細胞急性淋巴性白血病」,這群癌童目前在第一線治療即有不錯成績,但其中仍有約1.5成患者治療反應不佳或復發,以往的治療策略是需要進行異體造血幹細胞移植。由於移植需找尋合適的幹細胞捐贈者並需長期服用免疫抑制劑,以避免發生排斥反應,癌童的抗病戰爭從2至3年變成一輩子,無論是居家生活與返校學習品質或是自我實踐都受到強烈限制,不僅對於孩童而言身心負擔極大,父母更是不捨看到孩子一輩子要活在疾病限制中。CAR-T細胞是嵌合抗原受體T細胞(Chimeric Antigen Receptor T Cells)的簡稱,CD19 CAR-T細胞治療適用於難治與復發型的「B細胞急性淋巴性白血病」與「B細胞淋巴瘤」患者。CAR-T細胞治療仰賴高技術的基因工程,先從病人體內分離出T細胞,並透過基因改造,在T細胞上安裝可以鎖定癌細胞的導航標靶,籌措一支可精準、持續消滅癌細胞的免疫大軍,一次性注射即有望為癌末病人帶來治癒希望。有鑑於CAR-T細胞治療是全球癌症治療趨勢,臺大醫院歷經數年努力,全力籌設符合現行法規之細胞製備場所(GTP實驗室)與臨床細胞治療中心及引進國際細胞治療品質管理系統,並於今年4月率先成為台灣首家可正式提供臨床使用CAR-T細胞免疫療法之醫學中心,也帶領台灣成為亞太地區可提供該尖端醫療服務之國家。對於「兒童與年輕成人B細胞急性淋巴性白血病」以及「瀰漫性大B細胞淋巴瘤」的患者而言,即刻起只要把握治療時機,也能像亭亭一樣順利康復。
57歲男「愛吃胃藥止痛」 驚覺不妙就醫竟已癌末
57歲的許先生經常腹部悶痛不適,肚子餓會痛、吃飽也痛,服用胃藥後疼痛便會稍有舒緩,因此不以為意,直到一年多前腹痛難耐,才驚覺不對勁,進一步就醫檢查後竟被診斷為晚期胃癌。突如其來的噩耗打亂原本安穩的生活,從沒想過一般的胃痛竟會變得這麼嚴重,所幸在醫師建議下,許先生得以及早使用合適的治療方式,如今已恢復從前活力,重拾熱愛的羽球,積極勇敢抗癌。胃癌初期症狀難以辨別,多數患者確診時已是晚期,且轉移性胃癌存活期中位數約僅一年,因此要如何延長患者存活期為首要治療目標。隨著醫療科技的進步,癌症治療有眾多突破性的研究,高雄醫學大學附設醫院內科學講座教授暨國家衛生研究院癌症研究所特聘研究員陳立宗教授說明:「以免疫療法為例,日前也核准用於HER2陰性晚期胃癌治療,此治療選擇突破存活期不到一年的困境陣容多了一位精兵。」胃癌的發生與日常生活習慣息息相關,菸酒、老化、家族史等皆可能提高罹患胃癌的風險,其中,老化、幽門螺旋桿菌感染及不良的飲食習慣更為亞洲人胃癌致病主因。根據最新癌症登記報告顯示,胃癌已蟬聯十大癌症超過20年,雖發生人數於十大癌症中排行第九,死亡人數卻位居第六,致死率不容小覷。由於胃癌症狀多為非特定性,類似胃潰瘍、胃食道逆流等腸胃疾病,除非能儘早進行內視鏡檢查,早期發現十分困難,約有4成胃癌患者確診時癌細胞多已屬無法切除之局部晚期或轉移性胃癌,無法透過手術完全清除腫瘤,故晚期胃癌治療中,全身性化學藥物治療扮演著相當重要的角色,能夠幫助患者控制病情與延長生命,是第一線治療的標準療程,雖然目前已有標靶藥物,但只適用於HER2陽性患者,其餘超過9成HER2陰性患者則不適用。陳立宗教授進一步補充:「晚期胃癌患者首要治療目標為延長存活期、延緩疾病惡化及緩解症狀,如果能在身體狀況較佳的情況下接受治療,患者對藥物能有較佳之耐受性,治療能發揮更好的療效,因此癌症第一線治療尤為重要,應於一線治療及早選用合適且效果較佳的治療方式。」近年來,免疫療法成為癌症治療新趨勢,相較於過去傳統治療方式多為直接攻擊癌細胞,免疫療法是經由喚醒自身免疫系統加以攻擊或消滅癌細胞,台北榮民總醫院腫瘤免疫治療中心陳明晃主任表示:「目前免疫藥物也核准用於晚期胃癌治療,除了可在第三線接力使用外,亦能在第一線與傳統化療藥物合併使用,有望使更多患者受惠。且經最新臨床研究證實,可達到較佳的治療效果,能有效延長患者存活期,可謂晚期胃癌治療10年來的重大突破。」陳明晃主任進一步說明:「台灣癌登資料顯示,轉移性胃癌患者單用化療整體存活期為7個月、單採手術切除整體存活期為3.9個月,而免疫合併化療突破過往存活期不滿一年的困境,讓晚期胃癌治療困境出現一道曙光,且研究結果顯示,有6成患者腫瘤明顯縮小,相較於傳統化療,有較良好的長期疾病控制,讓患者能夠擁有較佳的生活品質1,建議患者盡早與醫師討論免疫治療的可行性。」目前晚期胃癌的治療整體預後仍然不佳,如何早期發現、早期治療是當前面臨的課題。陳立宗教授呼籲:「胃癌好發族群大多為60歲以上之長者,但近年臨床觀察,30至40歲的患者也屢見不鮮,且近年來飲食衛生條件的提升及幽門螺旋桿菌廓清治療的廣泛使用下,胃癌發生人數並未持續減少,民眾平時應多注意健康飲食攝取,多吃蔬菜水果,少吃煙燻、醃漬食物。若持續出現腸胃不適症狀,如:胃脹痛、消化不良、食慾差、甚至消瘦等,應盡快就醫檢查,不可輕忽當作只是一般腸胃不適,積極且正確地治療為對抗癌症之不二法門。」
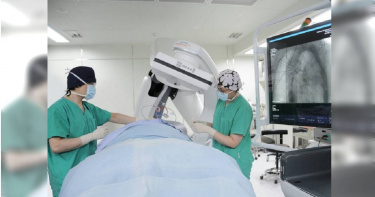
擊敗癌王3/「癌細胞晶片」代替患者試藥 有助掌握免疫治療效果
依據衛福部109年統計,肺癌是國人癌症死亡率冠軍,目前治療方式分為全身性治療與局部性治療。全身性治療包括像過去常聽到的化療,及近幾年較新的標靶治療與免疫治療等,大多用於晚期及末期的病人,通常會產生全身性副作用,例如:虛弱、腸胃道潰瘍、免疫力問題等。而局部性治療,主要重點在於破壞腫瘤,大致又可分為外科切除手術、放射線治療、腫瘤消融法(冷凍或高溫)等方式,治療後只會有些局部反應,不會產生全身性的副作用問題。國泰醫院胸腔外科主任顏銘宏指出,外科微創切除手術是現今治療肺癌的主要方式,醫院目前以單孔胸腔鏡手術及達文西機器手臂手術為主,雖然已較傳統開胸手術大幅降低手術傷害及併發症,讓病人提早復原。但對於高齡或心肺功能不佳難以負荷手術的病人而言,微創手術仍具有一定風險。且對於多發性肺腫瘤患者,過多的肺部組織切除,也會造成肺功能永久性缺損,因此需要更加微創的方法。冷凍微針消融術是一種微侵入的癌症治療方式,醫療團隊經由影像系統(超音波或是電腦斷層攝影)掃描導引下,將直徑1.47mm的超細冷凍微針插入腫瘤組織中,利用超低溫來破壞腫瘤組織、消滅癌細胞,通常只需局部麻醉,傷口極小,在經團隊專業照護下病人大多於術後隔天便可出院。國泰醫院自2016年起執行肺腫瘤冷凍微針消融術,至今已處理超過100顆以上的腫瘤,消融成功率超過9成,亦無發生嚴重併發症。根據衛福部資料顯示,煮食時未使用抽油煙機,罹肺癌風險較有使用者風險高8.3倍。(圖/報系資料庫)至於全身性治療如標靶治療、化療及免疫治療,雙和醫院胸腔內科李岡遠醫師指出,要如何為患者病情選擇適合的治療方式與藥物是一大難題。為精準治療,李岡遠與清華大學劉承賢教授合作開發「仿生肺組織晶片」,提取患者癌細胞在體外重組晶片,李岡遠醫師表示,仿生肺組織晶片就等同病人,醫師可透過晶片測試不同藥物濃度與組合,進而找到最完美的治療方式,可謂「替身醫療」。李岡遠指出,「仿生肺組織晶片」最重要的特色在於測試「免疫治療效果」,免疫治療即透過抗體藥物讓T細胞能重新恢復活性,並開始大量增生去攻擊腫瘤,進而成功治療癌症。不過,目前肺癌免疫治療平均每5人僅1人有效,李岡遠強調,每5人僅1人有效,不代表其它4人沒救,仿生肺組織晶片因為有患者的T細胞與癌細胞,此時就能再測試免疫治療藥物合併其它藥物的療效,為另外4人找出可能的解方。目前仿生肺組織晶片已得到2021年科技部『未來科技獎』的肯定,希望透過向國際期刊發表更多研究成果,未來能提供癌友更佳的精準治療。顏銘宏則提醒,抽菸、家族病史、空汙、油煙,及50歲以上亞洲女性等,都是肺癌的危險因子,尤其近來發現有不少病人無症狀,卻因健檢意外發現,因而呼籲民眾如有咳嗽、呼吸急促等症狀,盡早就醫,無症狀者也應定期健檢。

癌症疫苗通過動物測試 準備進入人體實驗階段
新冠肺炎來的又快又急,全球藥廠的確現在都加緊腳步開發疫苗。但相對於新冠肺炎,人類對抗癌症的歷史更加悠久,希望能研發疫苗抑制癌症的惡化,但現在傳出有大學研究團隊開發癌症疫苗成功,目前已經通過動物試驗,準備進入到人體實驗階段。據悉,癌症細胞的本質,其實就是人體細胞異化與失控,幾乎所有人體的細胞都有癌病變的可能性,但隨著醫學界對癌細胞的了解,發現到其實人體的免疫系統其實也會對抗癌細胞,只是癌細胞會欺騙免疫系統,只要欺騙成功就會出現癌化。在過去的幾十年中,其實著重點就是放在「免疫檢查點抑製劑」的開發,目的就是抓到癌細胞對免疫系統的騙術。其主要的概念是,人體免疫細胞中有一種T細胞,他是主要對付癌細胞,但由於殺傷力過強,為了避免誤殺正常細胞,T細胞動手前會先用自身的表面蛋白PD-1來進行檢查,這個PD-1會與正常細胞上的PD-L1結合,如果結合成功的話,T細胞就能判斷這是不能下手的正常細胞。而癌細胞就是會偽造PD-L1來欺瞞T細胞。而「免疫檢查點抑製劑」主要就是抑制T細胞身上PD-1的效果,讓T細胞直接無視檢查進行攻擊。根據《New Atlas》報導指出,美國俄亥俄州立大學的研究團隊發明了「PD1-Vaxx」免疫療法。該療法主要是活化T細胞與另一種免疫細胞「B細胞」(主要用來製造抗體、對抗病毒與癌症)。其原理是當PD1-Vaxx進入人體內後,會與B細胞發生反應,B細胞透過與PD1-Vaxx的反應,複製更多的PD1-Vaxx給T細胞,T細胞在獲取PD1-Vaxx之後,就能透過類似更新病毒庫的方式進行提升,此時癌細胞再偽造舊版本的PD-L1就無法欺瞞T細胞,進而被T細胞消滅。用這種方式可以有效的引導免疫系統精準的瞄準、消滅癌細胞。目前研究人員表示,他們在10隻罹患結腸癌的動物體內實驗此方法,其中9隻獲得了正向的效果,同時也透過先前的臨床前測試,確認疫苗安全性無虞。美國FDA也在11月批准該實驗進入第一期人體實驗階段,稍早時間澳洲也批准進行第一期臨床實驗。
主婦無症狀竟罹肺癌 冷凍微創幫助保留肺葉
一名63歲家庭主婦完全無任何症狀,卻於健康檢查時發現肺部有5顆腫瘤!確診為右下肺肺腺癌合併兩側肺轉移,共有5顆腫瘤,經胸腔鏡微創手術切除原發腫瘤接續口服標靶藥物治療,半年後轉移腫瘤明顯縮小,穩定控制。但一年後追蹤卻發現左上肺靠近肺門處本已縮小的腫瘤又不斷長大,若要以切除方式處理,必須切除左上肺葉,病人付出的代價極高,因此建議病人接受冷凍微針消融術,配合複合式手術室高端儀器設備輔助,手術順利隔天出院,半年後斷層掃瞄追蹤發現腫瘤消失,呼吸功能正常,生活不受影響。癌症長年來一直是國人十大死因之首;而肺癌更是癌症死亡原因中排名第一位,同時肺臟也是其他器官惡性腫瘤最常轉移的部位。因此,對於肺惡性腫瘤的治療是非常重要的議題。目前對於肺惡性腫瘤的治療可分為全身性治療與局部性治療。全身性治療包括像過去常聽到的化學治療,及近幾年較新的標靶治療與免疫治療等,大多用於晚期及末期的病人,通常會產生全身性副作用,例如:虛弱、腸胃道潰瘍、免疫力問題等。而局部性治療,主要重點在於破壞腫瘤,大致又可分為外科切除手術、放射線治療、腫瘤消融法(冷凍或高溫)等方式,治療後只會有些局部反應,不會產生全身性的副作用問題。國泰綜合醫院胸腔外科主任顏銘宏指出,外科微創切除手術是現今治療肺腫瘤的主要方式,醫院目前以單孔胸腔鏡手術及達文西機器手臂手術為主,雖然已較傳統開胸手術大幅降低手術傷害及併發症,讓病人提早復原,但對於高齡或心肺功能不佳難以負荷手術的病人而言,微創手術仍具有一定風險。且對於多發性肺腫瘤患者,過多的肺部組織切除,也會造成肺功能永久性缺損,因此需要更加微創的方法。冷凍微針消融術,是一種微侵入的癌症治療方式,醫療團隊經由影像系統(超音波或是電腦斷層攝影)掃描導引下,將直徑1.47mm的超細冷凍微針插入腫瘤組織中,利用超低溫來破壞腫瘤組織、消滅癌細胞。通常只需局部麻醉,傷口極小,手術配合於複合式手術室(Hybrid Operation Room)執行,因該手術室具備新型C型影像手臂等各種高端先進儀器設備,可提供醫療團隊在麻醉、定位、術中即時影像輔助術後檢查確認等手術過程,同步且同時於一站完成,不但可減少手術運送過程風險,更能即時處理術中出血等手術併發症,在經團隊專業照護下病人大多於術後隔天便可出院。國泰綜合醫院自2016年起執行肺腫瘤冷凍微針消融術,至今已處理超過100顆以上的腫瘤,消融成功率超過9成,亦無發生嚴重併發症。冷凍微針消融術可給予病人接近手術的治療效果,不失為治療選項之一。胸腔外科主任顏銘宏提醒,抽菸、家族病史、空汙、油煙,及50歲以上亞洲女性等,都是肺癌的危險因子,尤其近來發現有不少病人無症狀,卻因健檢意外發現,因而呼籲民眾如有咳嗽、呼吸急促等症狀,盡早就醫,無症狀者也應定期健檢。

最致命乳癌讓女漢子哭了 丈夫佯裝堅強暗自辛酸
今年59歲的阿芳4年前罹患三陰性乳癌,開刀後做了6次化療,結果5個月就復發,癌細胞轉移到肺部「整個滿天星」,再度化療後癌細胞雖然消失,但不到1年多,肺部又出現1公分腫瘤,二次復發讓阿芳幾乎失去信心,原本個性堅強、看似鐵人的阿芳,數度因不捨孩子而流淚,支撐阿芳活下去的動力,正是來自於家人,阿芳的兩個女兒都還在念書,丈夫陪著她面對癌症病情,雖然震驚、崩潰,卻從未在阿芳面前顯露,始終表現得很堅強,阿芳還是透過友人,才知道結婚25年的先生心裡這麼難受。而遠在花蓮家鄉的老母親,阿芳也是去年才敢讓她知道病情。在接受化療加上免疫治療3個月後,目前腫瘤已消失,阿芳說:「雖然三陰性乳癌不好治,但是只要撐過5年不復發,之後復發率就很低,我要積極治療等待後援。」一直以來,乳癌是國內婦女癌症的頭號殺手,其中三陰性乳癌因缺乏相對應的藥物治療,被視為難以治療的乳癌類型。然而,台灣本土性臨床研究顯示,三陰性乳癌手術治療後3年是復發和轉移的危險期,醫師呼籲及早積極治療,尤其是部分對化療反應差的晚期患者,建議搭配免疫療法,有助降低疾病惡化和死亡風險,挽留生機。台北長庚紀念醫院乳房醫學中心顧問級主治醫師陳訓徹教授指出,近年三陰性乳癌的藥物研發出現重大突破,一掃過去20年沒有新藥可用的陰霾。目前可透過精準抑制癌細胞特定抗原,喚醒自身免疫能力來消滅癌細胞,並且抑制乳癌細胞的生長與複製,進而達到疾病治療和控制的效果。陳訓徹教授表示,免疫治療建議搭配化療使用,因為化療在殺死癌細胞的過程中,會釋放出一些訊息,一方面讓免疫細胞更清楚辨識敵人及其所在地,另一方面也能更精準地進行攻擊。研究發現,晚期三陰性乳癌患者中,約4成屬於PD-L1陽性族群,適用於免治療法,且併用化療可延命逾2年,降低近4成疾病惡化風險和死亡風險。「牽妳的手,走咱的路」,是「社團法人中華民國乳癌病友協會」(Taiwan Breast Cancer Alliance,簡稱TBCA)對姊妹的承諾,理事長黃淑芳表示,新確診的乳癌病友,因為對治療不甚了解,容易產生不安與懼怕,很可能選擇隱身逃避,而不接受後續治療,復發的病友也可能因為心灰意冷而放棄治療,不過醫學日新月異,治療藥物持續進步,對付棘手的三陰性乳癌醫界不再束手無策,病友們只要堅持下去,就會看到希望;同時,也期盼政府能在健保藥物上多給予支持,幫助病友減輕經濟壓力,抗癌更安心!