安特羅生技
」 國光生技 疫苗 腸病毒 破傷風 安特羅
破傷風疫苗可望脫離健保缺藥名單!國光生技宣布最快11月復產上市
國產破傷風疫苗可望於今年底復產上市!國光生技(4142)今天(24日)宣布,已完成國光破傷風疫苗的藥證展延,最快11月供貨醫療院所,並預計2025年將現有的破傷風疫苗再升級為單支針劑,更方便急診及臨床醫師使用,每年至少可穩定供應100萬劑。國光生技表示,為符合國際PIC/GMP及美國FDA標準,進軍國際市場,斥資三億元於2019年投入新廠建設,2022年底完工,2023年第一季已通過衛福部食藥署GMP查廠認證,經完整的試產確效後,於2023年10月順利完成藥證展延,重新投產。由於近年來台灣破傷風疫苗多仰賴印度、東南亞進口,因供貨不穩,醫療院所屢傳缺藥荒,破傷風疫苗持續列在健保缺藥名單中;而國光破傷風類毒素是唯一取得藥證的國產破傷風疫苗,完成婦產,期能滿足疫苗自給自足的目標,徹底解決台灣破傷風疫苗缺藥問題。國光破傷風疫苗由國光生技子公司安特羅(6564)銷售,安特羅生技總經理張哲瑋指出,國光以最高國際規格興建全新單獨生產破傷風疫苗廠,完成台灣唯一的破傷風疫苗廠,且在國際上獨立生產破傷風疫苗產線,屈指可數;優先滿足台灣防疫需求外,將推廣到中國大陸、日、韓、歐美市場。此外,安特羅鎖定越南一年超過100萬的新生兒市場,已在今年9月在腸病毒71型疫苗(EnVAX-A71)與越南國營最大疫苗公司VABIOTECH簽訂代理銷售合約,率先佈局越南市場做為進軍東南亞的前哨站,一旦腸病毒疫苗在越南取得藥證,預計2025年在越南上市。

國產腸病毒71型疫苗前進東南亞! 安特羅越南國營VABIOTECH簽約估2025年上市
國光生技子公司安特羅生技(6564)26日宣布,腸病毒71型疫苗EnVAX-A71與越南國營最大疫苗公司VABIOTECH簽訂代理銷售合約,率先佈局越南市場做為進軍東南亞的前哨站。未來更將目標鎖定一年超過二千萬劑的東南亞各國新生兒市場,同時進一步佈局進入中國大陸市場。安特羅表示,腸病毒疫苗除了供應台灣幼兒防疫外,由於安特羅腸病毒疫苗已在越南完成三期臨床收案,再加上越南也是腸病毒71型流行區,對疫苗需求殷切,安特羅鎖定越南一年超過100萬的新生兒市場,預計2025年在越南上市。安特羅也曾是鑽石投資(6901)成立初期投資的公司之一,在安特羅興櫃之後,鑽石即友善退場;其腸病毒71型疫苗EnVAX-A71以台灣流行之B4亞基因型病毒株,配合國光生技新一代高產能細胞培養生物反應器製程,於今年3月17日領取藥證,8月2日公告即日起正式供貨,提供適用於2個月以上至未滿6歲嬰幼兒的主動免疫接種。安特羅生技總經理張哲瑋指出,安特羅腸病毒疫苗上市以來,在台灣的銷售穩定成長,由於安特羅腸病毒疫苗原液生產線,明年底可望從國衛院移回國光生技細胞廠,產量將明顯放大。安特羅自腸病毒疫苗在台灣取得藥證後,即與越南國營最大疫苗公司VABIOTECH簽訂腸病毒疫苗銷售合作備忘錄,經過半年的洽談確認市場需求,最近雙方更進一步完成代理銷售合約簽訂,一旦腸病毒疫苗在越南取得藥證,即可在越南上市,為前進東南亞市場的第一站。腸病毒為亞洲流行的傳染病,五歲以下幼童感染腸病毒71型易併發重症。1998年台灣首次爆發嚴重手足口病(hand, foot and mouth disease)及皰疹型咽唊炎(herpangina),高達140萬名孩童感染,405名併發重症、78名幼童不幸死亡,其中引起神經系統嚴重併發症主因為腸病毒71型。
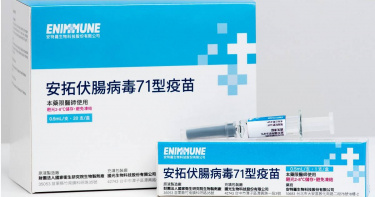
國光生技子公司13年花15億研發首個本土腸病毒疫苗獲藥證 今年Q1上市
國光生技(4142)與子公司安特羅生技(6564)今(29日)宣布,本土自主研發生產的腸病毒71型疫苗(EnVAX-A71)獲衛福部食品藥物管理署(TFDA)審查通過取得藥證,預計今年Q1上市。71型疫苗是第一個純由國人自身從研發到上市的人用疫苗,代表了台灣在生技產業的能量和驕傲,更是重要的里程碑。國光集團董事長詹啟賢表示,腸病毒疫苗前後耗時13年、耗費15億元,動員大量團隊人力,克服重重困難,寫下國產疫苗自研發到量產成功上市新猷,未來除優先供應台灣幼兒接種外,將前進東南亞、韓、日、中國大陸,讓MIT疫苗在國際發光。國光集團董事長詹啟賢指出,腸病毒疫苗原先係於2009年承接國衛院一期臨床試驗,並後續完成二期人體臨床試驗,隨後國光生技為提升疫苗品質及生產技術以符合市場商業量產需求,進一步研究開發將原本國衛院轉瓶生產技術提高精進至生物反應器(Bioreactor)製程,以取得量產的穩定性和純化品質,更因此加做了一次二期人體臨床試驗。接著投資成立子公司安特羅生技,共同完成三期人體臨床試驗並完成製程開發及品管確效指標。安特羅成功取得藥證的腸病毒71型疫苗,以台灣流行之B4亞基因型病毒株,配合國光生技新一代高產能細胞培養生物反應器製程。上市後,將優先保護台灣幼兒免於腸病毒威脅,為防疫再添利器。安特羅指出,由於此腸病毒疫苗對東南亞及中國大陸的流行病毒株亦有交叉保護證明,為佈局東南亞市場,近期內將在越南完成三期臨床試驗,也與越南國營最大疫苗公司簽訂腸病毒疫苗銷售合作備忘錄,未來更將目標鎖定一年超過二千萬劑的東南亞各國新生兒市場,同時進一步佈局進入中國大陸市場。腸病毒為亞洲流行的傳染病,五歲以下幼童感染腸病毒71型易併發重症。1998年台灣首次爆發嚴重手足口病及皰疹型咽唊炎,高達140萬名孩童感染,405名併發重症、78名幼童不幸死亡,其中引起神經系統嚴重併發症主因為腸病毒71型。安特羅腸病毒71型疫苗具優異交叉保護力,深具國際市場潛力。

「快篩國家隊」成軍!每月生產300萬劑 由政府進行分配
國內新冠肺炎本土疫情再起,確診率每天創新高,雖然這波疫情多以輕症患者為主,但這也凸顯了,篩檢速度的重要性。有鑑於此,國內即將成立所謂的「快篩國家隊」,並由政府啟動徵收,據《中央社》報導,檢測試劑廠寶齡富錦昨天(12日)表示,今天起,廠內的所有出貨,都將交由指揮中心統籌分配,算算目前每月約有300萬劑產能,若有國軍協助包裝作業,產能預期可再增加。因應篩檢量能增加,家用快篩用品成為國內目前最迫切需求的東西,中央流行疫情指揮中心指揮官陳時中昨天表示,政府接下來會主動組織讓「快篩國家隊」成軍,且未來家用快篩試劑售價,至少會降至每劑約新台幣200元以下。寶齡富錦發言人丁爾昆受《中央社》採訪表示,場內試劑產品,每天可生產約20萬劑,但每人每天頂多只能包裝數百或數千劑。若能仿照「口罩國家隊」概念,由國軍協助包裝,產能有望從目前每月約300萬劑再提升,但實際數字還無法估算。而國光生技子公司安特羅生技指出,現在每月產能在100萬劑以內,除了人力支援外,供應商也需調降材料成本,才有辦法配合政策,不過徵用的最後價格,目前還沒確定。

股民要國光生代工 網友駁:做出自己品牌才是最重要的
疫情爆發,國產疫苗進度成為萬眾矚目焦點,不僅攸關疫情是否能夠緩和,股價也成為投資人關心議題。隨著高端疫苗股票不斷上漲,疫苗老牌國光生技屢遭股民質疑,表示應該要「爭取代工,疫苗慢慢研發」,但也有網友認為:「做出自己的品牌出來那才是最重要的」,雙方看法不同,卻都希望疫苗能夠「安全研發」。台灣疫苗老牌國光生技(4142)在今(2021)年初宣布,將於國內外重啟後續臨床試驗,採取更多不同國家、人種進行測試,獲得國際認同。同時表示「疫苗需求不是短時間內就會消失,所以有計劃地準備做到三期試驗,正式領藥證」,並且因應變種病毒,將開發次世代疫苗作為長期防疫需求。話雖如此,但自5月疫情爆發以來,國光生技進度也再次被搬上檯面。一名網友於《股市同學會》中表示國光生技應「爭取代工生產」,因為「代理或代工至少能讓股價成長」,否則這段時間產線將閒置。有留言附和:「先爭取代工,疫苗慢慢安全研發」。其他網友則認為:「把新冠肺炎疫苗做得更好,通過國外三期試驗,那才是真正要走的路,而不是只是做個代工」。這名網友補充:「不是說代工不好,國光生應該走出他自己的一條路,做出自己的品牌出來那才是最重要的」。透過留言可見,雖然目前疫苗吃緊,但也仍有不少民眾更看重國產疫苗「品質」,看好國光生技能以豐富疫苗研發經驗,生產出令人安心的台灣新冠肺炎疫苗。據了解,國光生技除了積極爭取新冠疫苗的國際地位外,目前也正在持續布局流感疫苗海外市場,已在本(5)月初取得清真認證,25日也宣布與旗下安特羅生技,攜手新加坡InnovaluesTech集團簽訂合作備忘錄,將在今年底於東南亞籌組合資公司,負責推動流感疫苗、腸病毒疫苗、破傷風疫苗等產品進軍東南亞市場。

國產3支疫苗前進東南亞!國光生、安特羅偕新加坡淡馬錫 籌合資公司推動
國光生技(4142)宣布,國光生技、安特羅生技和新加坡北極星控股集團旗下Innovalues Tech公司簽訂合作備忘錄,將在今年底於東南亞籌組合資公司,負責推動流感疫苗、腸病毒疫苗、破傷風疫苗等產品進軍東南亞市場。新加坡北極星控股旗下InnovaluesTech集團資本額 3.5億美金,旗下子公司有8家,集團定位是從事生物醫藥相關需求的醫藥產品佈局及投資,目前已在新加坡、印尼及馬來西亞投資多家醫療中心,並從事相關醫藥服務。國光生技於5月25日宣布,國光生技、安特羅生技與InnovaluesTech合資公司,將負責在東南亞執行臨床試驗、藥證申請和產品銷售,初期將以流感疫苗、腸病毒疫苗和破傷風疫苗為主要合作項目,未來包括新冠疫苗等各項新產品,都將透過合資公司,成為國光生技前進東南亞市場的重要據點。國光生技表示,基於國際化市場布局,海外籌組合資公司有助於在當地的臨床合作、藥證申請和開展銷售通路,若此模式運作良好,未來將不排除持續在海外設點。根據調查,北極星控股為新加坡政府百分百主權基金淡馬錫控股旗下所有,也就是說,國光生技此次與Innovalues Tech合資公司簽訂的合作備忘錄不僅僅是疫苗產品的推動,更是開啟台灣與新加坡兩國在疫苗產業上的進一步發展。加上日前國光生技流感疫苗取得的清真認證,台灣疫苗業的南向發展將更深耕。

夭壽!網售800元快篩試劑 國光生技急公告:請勿受騙上當
國內疫情嚴峻,全國升至3級警戒,不少民眾心惶惶,想去醫院做快篩,又怕加深群聚感染,不料竟有不良業者趁疫情之亂,在LINE上群組販賣快篩試劑,對此,國光生技也於臉書粉專發出聲明表示:「快篩試劑屬醫療器材,僅供衛生局及醫療機構,沒有任何私下販售」,呼籲民眾「請勿受騙上當!」國光生技旗下子公司安特羅自主開發的快篩試劑「Speedy 新型冠狀病毒抗原快速檢驗試劑」已取得衛福部專案製造許可及歐盟 CE-IVD 認證,靈敏度達 9 成以上、特異性達百分百,更是目前唯一經實證可辨別英國變種病毒株的快篩試劑。同時因操作簡單,15 分鐘內即可得知結果,成為有心人士拿來詐騙之由。近日就有不良業者想趁疫情恐慌劫財,在LINE上群組販售標明為「國光生旗下安特羅」的新冠檢疫快篩,表示「準確度高達92.3%以上,15分鐘內可得知結果」。詐騙份子強調自己是「直接跟工廠拿到貨」,因疫情危急,去醫院快篩費用高又怕人多危險,呼籲「大家一起自我快篩~保護自己也保護他人」。LINE截圖中還提到,快篩試劑是「疫情期間一定必備的」,鼓勵「民眾、團體、公司行號來團購」,指出「一般件採檢費用約為5000元,速件採檢費用約為7000元」,如果自備快篩「個人試劑一只800(元)」。對此,安特羅生技總經理兼發言人張哲偉今(20)回應表示,並無接獲此消息,也無做任何私下販售。因快篩試劑屬醫療器材,所以安特羅只賣給衛生局跟醫療機構,包含一些廠商、公司行號、私下詢問想購買的都是一律拒絕。國光生技於臉書呼籲民眾:「請勿受騙上當」。(圖/國光生技臉書)因應本土疫情擴散,安特羅也於17日宣布,將原先預定外銷的20萬快篩試劑先行提供國人使用,在第一時間就已分發直送至台北、台中、彰化三地篩檢站,全力支援防疫。另外,國光生技也在臉書粉專第一時間發出聲明表示:「國光生技子公司-安特羅生技所研發之快篩試劑屬醫療器材,僅供衛生局及醫療機構,沒有任何私下販售」,提醒民眾「疫情當頭,請大家務必提高警覺,切莫輕信網路謠言!」同時也提醒「如有接獲消息,歡迎通報,依違反醫療器材管理法第18條公告的限制規定,可處3萬以上100萬以下的罰鍰」,呼籲大家「請勿受騙上當」。

一年奪走78幼童!台灣10年磨劍 研發腸病毒71型疫苗防禦
由於過去感染手足口病等嚴重造成死亡案例中,是以感染腸病毒71型(EV71)併發重症死亡為主,也正是目前國內安特羅等二家生技公司研發腸病毒疫苗過程中,優先以致命率高的71型為突破對象。根據疾管署2020年1月發布的監測資料顯示,今年迄今共12例腸病毒71型輕症、5例腸病毒71型重症,累計1例腸病毒併發重症病例。而去(2019)年累計共402例EV71輕症、68例腸病毒併發重症病例(含4例死亡),以感染腸病毒71型為多(53例)。以2019年案例來看,腸病毒EV71輕症出現於19個縣市,而重症病例則出現於17個縣市。安特羅生技指出,腸病毒是一種亞熱帶流行疾病,腸病毒71型致病率特別高,尤其是神經系統的併發症,5歲以下幼童發生率達90%,常合併嚴重併發症,致死率高,大約有10萬分之一到萬分之一的致死率。1998年台灣爆發嚴重的手足口病(hand, foot and mouth disease)及皰疹型咽唊炎(herpangina)大流行,造成78個幼童死亡,已證實為感染腸病毒71型(EV71)併發重症死亡。(圖/截至疾管署官網)

「拼台灣第一」腸病毒疫苗有望今年上市! 國光生子公司安特羅停牌將公開說明
疫苗廠國光生(4142) 旗下子公司安特羅生技(6564) 今天停牌並於下午在櫃買中心召開記者會。市場預測可能是說明其研發的腸病毒 71 型疫苗經過臨床三期試驗與觀察期的期中分析報告。據參加臨床試驗醫院方傳出的消息,樂觀該疫苗帶來的成效。腸病毒疫情因為其較屬於亞洲地區的疾病之一,目前大陸已開發此種疫苗,而國內、且是亞洲區產能最大的疫苗廠國光生技(4142),其轉投資的安特羅生技已正積極優先研發可能致命的腸病毒71型疫苗,預計今年第2季取得藥證,於第4季產品上市,希望能藉此減緩疫情發生頻率。安特羅從去年4月展開其腸病毒71型疫苗三期人體臨床試驗,於4月29日完成第1200人收案,依規定觀察期半年後即可開始統計試驗成效結果。預計第2季完成三期臨床並正向食藥署(TFDA)提出藥證申請之外,也正準備在越南進行2500人收案的腸病毒疫苗三期審查,預計6月通過核准,2020年下半年開始執行三期臨床試驗。根據疾管署資料,至2019年10月累計333例腸病毒71型個案,其中42例為腸病毒併發重症,已經高於2016-2018年同期,其他分別感染腸病毒D68型、克沙奇A6型、A10型(各2例),克沙奇A9型、B5型、伊科病毒11型(各1例),造成停課班次已達258班以上,疫情呈逐年增長的趨勢。目前國光生技穩定供給國內所需防疫用疫苗,更投入大量研發技術從事國際藥證取得及新疫苗開發,譬如說有四價流感疫苗歐洲跨國性臨床試驗、腸病毒71型疫苗三期臨床試驗及H7N9禽流感疫苗三期臨床的規劃等。安特羅生技。(圖/翻攝官網)新疫苗研發包括重組蛋白次單位疫苗、細胞培養日本腦炎疫苗、登革熱疫苗等研發工作。國光生技表示,非常關切國內持續出現腸病毒感染病例及併發症狀況,其轉投資公司安特羅生技(6564)優先針對有可能致命的腸病毒71型,研發完成該疫苗,預計於2020年Q2申請藥證,一旦順利通過取得,產品最快可望於第4季上市,有助於改善我國腸病毒疫情。

國光生技今啟動「破傷風疫苗」等新廠案 預計2023年量產
國光生技(4142)曾是國內破傷風疫苗唯一生產供應廠,已於103年停止生產。考量國內長期需求及外銷商機,國光董事會今天決議啟動「全方位生技廠區」,將新建符合PIC/S GMP標準的破傷風疫苗廠,預計2023年投入生產。同時,也將啟動新的細胞培養廠、增擴支援系統及倉儲、品管實驗室及辦公室等興建,預計各項建置將於2022年及2023年逐步完成。國光生技目前數種開發中的產品,包括與子公司安特羅生技合作開發的腸病毒71型疫苗、準備進入人體臨床階段的日本腦炎疫苗、以及其他計畫開發的新型疫苗,都會使用細胞培養製程生產。因此公司將展開細胞培養廠的建廠工作,並預計在2023年底開始進入商業量產,以完善自有的全製程生產製造能力。目前國光生技建置中的第二條無菌針劑充填線預計於2021年完成後,充填生產產能將增加數倍,且根據已經與合作生產客戶間簽署的新合約,第二線完成後委託生產產品數量亦將倍數增加。為配合增加的原料及成品倉儲需求,在「全方位生技廠區」願景計畫中也包括了新建後勤支援棟及配套措施,以達成全方位成長的目標。公司將增建原料和成品的倉儲空間,擴大廢水處理廠,同時將擴增品管實驗室及辦公室空間。預計這些新的支援設施可於2022年完成建置並投入運作。

國光生技擬新建破傷風疫苗、細胞培養廠 預計3年內完成
國光生技(4142)今天宣布董事會已就擬定的「全方位生技廠區」願景計畫,討論,預定明年1月正式提案通過後執行,將以新建細胞培養廠、破傷風疫苗廠、增擴支援系統及倉儲、品管實驗室、辦公室等為主,預計三年內逐步完成。國光生技表示,該案是為了因應市場國際化、技術多元化與產品多樣化的布局,以「建立更全面的先進疫苗生產設施與能力」為主軸,配合公司新開發疫苗產品的生產,為將來擴大國際市場所增加的需求奠定基礎。目前開發中的疫苗產品,包括與轉投資公司安特羅生技合作的腸病毒71型疫苗、準備進入臨床階段的日本腦炎疫苗,以及計畫開發疫苗等,未來皆會配合該案的細胞培養廠建廠案,使用細胞培養製程及設施生產,完善國光生技自有全製程生產製造能力。國光生技董事長詹啟賢。(圖/李蕙璇攝) 國光生技還指出,過去國光生技曾經是國內破傷風疫苗的唯一生產供應廠,因舊廠於2014年停止生產,目前以歐洲進口的破傷風疫苗供應國內需求。考慮國內未來長期需求以及評估未來外銷的商機,正計畫重新建置符合PIC/S GMP標準的破傷風疫苗廠,將可在國產流感疫苗出口到國際市場同時,也能將國光生技自產的破傷風疫苗走上國際。國光生技表示,待新建廠計畫完成後,可用於生產流感疫苗的雞胚胎蛋生產廠及無菌針劑充填設施外,可再增加最新細胞培養廠及破傷風疫苗廠,有助於提升更多樣化疫苗、蛋白質藥品的自製力,以及與國內外夥伴合作生產力。

【台灣疫苗海外爭光3】外科主任到CEO 國光生技董座詹啟賢:9字箴言自我要求
國光生技(4142)董事長兼執行長詹啟賢,帶領團隊11年來挺過破產危機及國人期待的壓力,疫苗市場逐步擴展到歐美、大陸、泰國等東南亞地區,成為一家具有國際競爭力的上市公司。他以「不躁氣、不動氣、不怠氣」9字箴言自我要求,並將以取得可能致命的腸病毒71型疫苗藥證為新目標,希望改善我國疫情。腸病毒疫苗研發是由國光生技轉投資公司安特羅生技(6564)負責開發,預計明(2020)年Q2申請藥證,一旦順利通過取得,產品最快可望於第4季上市。國光生技董事長兼執行長詹啟賢的名字,近期除了在媒體財經版出現之外,也出現於政治版。當記者問起,詹啟賢處之泰然地說:「我是商界人士,早已不過問那些事。」清楚劃分界線,專注上市公司治理層面。國光生技是國內主要疫苗提供廠商,也是老牌生技公司,1965年成立,是亞洲唯一獲得歐盟GMP認證與美國FDA認證的流感疫苗製造公司,同時是台灣唯一符合PIC/S GMP規範人用疫苗生物製劑廠。國發基金挹注支持台積電、國光生技等其他公司,目前在國光生技持股16%,為其大股東,而晟德公司透過旗下玉晟管顧投入6.7億元,取得10.2%股權,為國光生技第二大股東。詹啟賢在辦公桌上的「不躁氣、不動氣、不怠氣」9字箴言,隨時給予自我要求。(圖/李蕙璇攝)詹啟賢提到,國光生技歷經Crucell違約、建廠停工、產能閒置等不斷虧損的深淵,只有面對重新開發新市場堅困挑戰,才能讓生產更上軌道,營收可望持續成長。期間,面對外界質疑他出任國光生技董事長酬庸之說,詹啟賢多次公開表態自己非官股代表,主要是接受前董事長李明亮遊說,深感台灣自行生產疫苗的重要性及可提升我國生技產業發展,而成為代表民股的董事長。對於「被誤解」與「被低估」,詹啟賢舉出日本、韓國的國產自製疫苗,受到政府保護而負責該國的流感疫苗100%市場,反觀我國卻是僅提供國光生技50%額度,且採價格競標制,待遇明顯有差。「國光生技是一家上市公司,面臨市場的商業競爭,戰戰兢兢,同時也要顧及國人面對H1N1大流行、流感、腸病毒疫情的生命威脅,扛起研發疫苗責任。」詹啟賢說他領軍國光生技的義無反顧心情。他還以漏斗「寬廣→瓶頸→寬廣」形狀,對照一路從學術、生產研究到動物、人體試驗,取得藥證、廠區符合GMP合格驗證等,雖是條漫長之路,通過挑戰建立高技術門檻,是國光生技團隊轉換為盈餘的機會。「在商業利益、國人需求之間取得平衡,國光生技團隊85%人員來自生物等相關科系,年資都10、12年以上,流動率低。我們努力在政府未給予許多保護措施中,走到海外開創疫苗出口市場。」詹啟賢自豪地說。(3-3全文完)詹啟賢相當喜愛書法字畫,辦公室掛著多幅名帖。(圖/李蕙璇攝)國光生技董事長詹啟賢彰化縣人,曾擔任美國洛杉磯波莫那醫院外科主任、逢甲醫院院長(奇美醫院前身)、衛生署署長、奇美醫院院長。2008年7月其個人也投資入股國光生技,並代表民股出任董事長兼執行長至今。

腸病毒疫苗可望明年上市 國光轉投資安特羅生技將申請藥證
腸病毒疫情因為其較屬於亞洲地區的疾病之一,除了大陸已研發出疫苗,其他世界各國還未跟進推出此類疫苗。而國內、且是亞洲區產能最大的疫苗廠國光生技(4142),其轉投資的安特羅生技已正積極優先研發可能致命的腸病毒71型疫苗,並於今(8)日宣布,預計明年第2季取得藥證,於第4季產品上市,希望能藉此減緩疫情發生頻率。根據疾管署資料,今年累計333例腸病毒71型個案,其中42例為腸病毒併發重症,已經高於2016-2018年同期,其他分別感染腸病毒D68型、克沙奇A6型、A10型(各2例),克沙奇A9型、B5型、伊科病毒11型(各1例),造成停課班次已達258班以上,疫情呈逐年增長的趨勢。目前國光生技穩定供給國內所需防疫用疫苗,更投入大量研發技術從事國際藥證取得及新疫苗開發,譬如說有四價流感疫苗歐洲跨國性臨床試驗、腸病毒71型疫苗三期臨床試驗及H7N9禽流感疫苗三期臨床的規劃等。新疫苗研發包括重組蛋白次單位疫苗、細胞培養日本腦炎疫苗、登革熱疫苗等研發工作。國光生技表示,非常關切國內持續出現腸病毒感染病例及併發症狀況,其轉投資公司安特羅生技(6564)優先針對有可能致命的腸病毒71型,研發完成該疫苗,預計於明(2020)年Q2申請藥證,一旦順利通過取得,產品最快可望於第4季上市,有助於改善我國腸病毒疫情。